
【题目】X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
A.33%
B.40%
C.50%
D.65%
【答案】D
【解析】解:假设X和Y物质的量为1mol,达平衡时消耗Y物质的量为nmol,则: X(g)+2Y(g)2Z(g)
起始量(mol):1 1 0
变化量(mol):0.5n n n
平衡量(mol):1﹣0.5n 1﹣n n
平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则
(1﹣0.5n+1﹣n):n=3:2
解得n= ![]()
Y的转化率= ![]() =67%
=67%
故选D.
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子反应方程式为( )
A.NH4HCO3溶于少量的浓KOH溶液中:NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O
B.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-![]() 3Fe3++NO↑+3H2O
3Fe3++NO↑+3H2O
C.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2
D.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO![]() ===BaSO4↓+H2O
===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组对某硫酸亚铁晶体(FeSO4xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。

(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4xH2O中的x= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是
A. 简单离子半径大小顺序: rX>rZ>rY
B. 元素W的氧化物对应水化物的酸性比Y的强
C. X与Y形成的原子晶体X3Y4的熔点比金刚石高
D. X与W形成的化合物和Z与W形成的化合物的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“西气东输”是西部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷.工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2 , 两者的体积比约为1:1.已知1mol CO气体完全燃烧生成CO2气体放出283kJ热量,1molH2完全燃烧生成液态水放出286kJ热量;1molCH4 气体完全燃烧生成CO2气体和液态水放出890kJ热量.
(1)写出H2完全燃烧生成液态水的热化学反应方程式: , 若1molCH4气体完全燃烧生成CO2气体和水蒸气,放出的热量 890kJ(填“>”、“=”或“<”)
(2)忽略水煤气中其它成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为;燃烧生成的CO2 的质量比约为 .
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I下面是几种实验中常用的仪器:
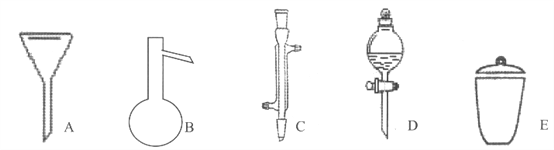
写出序号所代表的仪器的名称:
A__________;B__________;C__________;D__________;E__________
II实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、天平、量筒和__________________。
(2)用托盘天平称取氯化钠固体,其质量为__________g。
(3)下列主要操作步骤的正确顺序是____________________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度__________ (填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com