
����Ŀ������������Ԫ��X��Y��Z��W��ԭ��������������Xԭ�Ӻ��������������Ǵ�����2����Y�ķ�����YF3�����и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ��Z��ͬ������ԭ�Ӱ뾶����Ԫ�أ�W���������Ϊ+7�ۡ�����˵����ȷ����
A. �����Ӱ뾶��С˳��: rX>rZ>rY
B. Ԫ��W���������Ӧˮ��������Ա�Y��ǿ
C. X��Y�γɵ�ԭ�Ӿ���X3Y4���۵�Ƚ��ʯ��
D. X��W�γɵĻ������Z��W�γɵĻ�����Ļ�ѧ��������ͬ
���𰸡�C
��������Xԭ�Ӻ��������������Ǵ�����2����XΪCԪ����W���������Ϊ+7�ۣ����������������Ϊ+7�۵���ClԪ����WΪClԪ����Y�ķ�����YF3�����и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ��YΪVA��Ԫ�أ�Z��ͬ������ԭ�Ӱ뾶����Ԫ�أ����X��Y��Z��W��ԭ��������������YΪNԪ�أ�ZΪNaԪ����A���������ྶ�����С����ԭ�����Ӱ뾶��rY![]() rZ������B�W���������Ӧ��ˮ������HClO��HClO2��HClO3��HClO4��Y���������Ӧ��ˮ������HNO2��HNO3��W���������Ӧˮ��������Բ�һ����Y��ǿ��������HClO
rZ������B�W���������Ӧ��ˮ������HClO��HClO2��HClO3��HClO4��Y���������Ӧ��ˮ������HNO2��HNO3��W���������Ӧˮ��������Բ�һ����Y��ǿ��������HClO![]() HNO3������C�X��Y�γɵ�ԭ�Ӿ���ΪC3N4�����ʯҲ����ԭ�Ӿ��壬���ڼ�����C��N��
HNO3������C�X��Y�γɵ�ԭ�Ӿ���ΪC3N4�����ʯҲ����ԭ�Ӿ��壬���ڼ�����C��N��![]() C��C����������C��N��
C��C����������C��N��![]() C��C����C3N4���۵�Ƚ��ʯ�ߣ���ȷ��D�X��W�γɵĻ�������ֻ�й��ۼ���Z��W�γɵĻ�����ΪNaCl��NaCl��ֻ�����Ӽ�����ѧ�����Ͳ���ͬ������ѡC��
C��C����C3N4���۵�Ƚ��ʯ�ߣ���ȷ��D�X��W�γɵĻ�������ֻ�й��ۼ���Z��W�γɵĻ�����ΪNaCl��NaCl��ֻ�����Ӽ�����ѧ�����Ͳ���ͬ������ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A��g��+5B��g��4C��g��+6D��g�� ��5L���ܱ������н��з�Ӧ��30min��C�����ʵ���������0.30mol������������ȷ���ǣ� ��
A.30min��A��ƽ����Ӧ������0.010molL��1min��1
B.������D�����ʵ���һ��������0.45mol
C.������A��B��C��D�����ʵ����ı�һ����4��5��4��6
D.������A�����ʵ���һ������0.30mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ķϽ���м����Ҫ�ɷ�ΪCu��Fe��Al,�����������Al2O3��Fe2O3,�ó��������Ͻ���м��ȡ����Чˮ������Na2FeO4(��������)�Ȳ�Ʒ����������:
I.��Ͻ���м�м��������NaOH��Һ����ַ�Ӧ����ˣ�
��.��I���ù����м������ϡH2SO4����ַ�Ӧ����ˣ�
��.�������ù����м��������ȵ�ϡH2SO4,ͬʱ���Ϲ�������������ܽ��CuSO4��Һ��
��.����
(1)����I �з�����Ӧ�Ļ�ѧ����ʽΪ___________��___________ ��
(2)���������õ���Һ�м���KSCN��Һ��������������Һ�в�����Fe3+�������ӷ���ʽ��������ܵ�ԭ��: ___________ ��
(3)���������CuSO4 ��Һ�����ӷ���ʽΪ___________ ��
(4)����II ������Һ����һ���������Ƶ�Na2FeO4,��������:
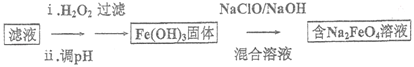
�ٲ����Һ��c(Fe2+)Ϊa mol/L,��Ҫ����1m3��Һ����������Ҫ����25%��H2O2��Һ___________kg(�ú�a �Ĵ���ʽ��ʾ)��
��д����Fe(OH)3��ȡNa2FeO4�Ļ�ѧ����ʽ: ___________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z�������壬ȡX��Y��1��1�����ʵ���֮�Ȼ�ϣ������ܱ������з������·�Ӧ��X+2Y2Z���ﵽƽ���û�������з�Ӧ��������ʵ�����������������ʵ���֮��Ϊ3��2����Y��ת������ӽ��ڣ� ��
A.33%
B.40%
C.50%
D.65%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����Ϊ��������ȱ�������涨��ʳ���б�����������ĵ���ء�����ʳ�����Ƿ�ӵ⣬���������·�Ӧ��
KIO3+ KI+ H2SO4�T K2SO4+ I2 + H2O
��1����ƽ�÷���ʽ��������˫���ŷ���ʾ�÷���ʽ����ת�Ƶķ�������Ŀ��____________________
��2���÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ______________��
��3�������Ӧ��ת��0.5mol���ӣ�������I2�����ʵ���Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��������������õ��Ľ�����ȷ����
ѡ�� | ʵ����������� | ���� |
A | �ⶨ�����ʵ���Ũ�ȵ�Na2CO3��Na2SO4��Һ��pH��ǰ�ߵ�PH�Ⱥ��ߵĴ� | Ԫ�طǽ�������S>C |
B | ��ʢ��Fe(NO3)2��Һ���Թ��м���0.lmol.L-1H2SO4��Һ���Թܿڳ��ֺ���ɫ���� | ��Һ��NO3-��Fe2+��ԭΪNO2 |
C | ��FeBr2��Һ�м���������ˮ���ټ�CCl4��ȡ��CCl4����ɫ | Fe2+�Ļ�ԭ��ǿ��Br- |
D | ����Һ�еμ������ữ��BaC12��Һ��������ɫ���� | ��Һ��һ������SO42- |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����(MnCO3) ������ĸ�����ǿ���Բ��ϣ�Ҳ���Ʊ�Mn2O3��MnO2���̵����������Ҫԭ�ϣ��㷺���ڵ��ӡ�������ҽҩ����ҵ��
(1) ��ҵ���Ʊ�����ʽΪ��MnSO4+2NH4HCO3=MnCO3 ��+ (NH4)2SO4+CO2 ��+H2O����Ӧ��ͨ��������Թ�����NH4HCO3���ҿ�����Һ��pHΪ6.8~7.4�������Թ�����NH4HCO3��Ŀ����_____��
(2) ʵ����ģ�ҵ���������Ʊ�������װ����ͼ4��ʾ��

��ʯ�����������________��
����Ӧ�����У�ΪʹSO2������ת����ȫ����ͨ��SO2��N2����һ�������ı��ҺͶ�ϵ������£��ɲ�ȡ�ĺ�����ʩ��________��
(3) MnCO3 �ڿ����м�����ת��Ϊ��ͬ��̬���̵���������������������¶ȵı仯��ͼ5 ��A��B��C��D ����ʾ����300��ʱ��ʣ���������Ԫ������Ԫ�ص����ʵ���֮�ȼ�n(Mn) :n(O)Ϊ_______�� ͼ�е�D ��Ӧ����ijɷ�Ϊ______ (�ѧʽ)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��Ӧ�����ӷ���ʽ��д��ȷ����
A. ����̼������Һ��ͨ�������Ķ�����̼��2Na++CO32-+CO2+H2O=2NaHCO3��
B. KIO3��KI��������Һ�з�Ӧ��5I-+IO3-+3H2O�T3I2+6OH-
C. ��Al2(SO4)3��Һ�м�������İ�ˮ��Al3++4NH3��H2O�TAlO2-+4NH4++2H2O
D. ����ʯ��ˮ�������Һ��ϣ�Ca(OH)2+2CH3COOH=Ca2++2CH3COO-+2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com