
��¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ��H =" a" kJ mol��1
2Fe(s)+3CO2(g) ��H =" a" kJ mol��1
��1����֪��
��Fe2O3(s)+3C(ʯī) = 2Fe(s)+3CO(g) ��H1 =" +" 489.0 kJ mol��1
��C(ʯī)+CO2(g) = 2CO(g) ��H2 =" +" 172.5 kJ mol��1
��a = kJ mol��1��
��2��ұ������Ӧ��ƽ�ⳣ������ʽK = ���¶����ߺ�Kֵ ������������䡱��С������
��3����T��ʱ���÷�Ӧ��ƽ�ⳣ��K=64����2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
| | Fe2O3 | CO | Fe | CO2 |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 2.0 | 1.0 | 1.0 |
��1��-28.5 ��2�� ��С
��С
��3����60% ��ac��©ѡ��1�֣���ѡ���÷֣�
��4����bc��©ѡ��1�֣���ѡ���÷֣� ��п
���������������1�����ݸ�˹���ɿ�֪?H=��H1 -3��H2=-28.5kJ?mol?1������a="-28.5" ��
��2����ΪFe��Fe2O3Ϊ���壬����ƽ�ⳣ������ʽΪ�� ����Ϊ�÷�ӦΪ���ȷ�Ӧ�������¶����ߣ�ƽ�������ƶ���Kֵ��С��
����Ϊ�÷�ӦΪ���ȷ�Ӧ�������¶����ߣ�ƽ�������ƶ���Kֵ��С��
��3���ٸ�������ʽ���м��㣺������һ����̼���ʵ���Ϊx
Fe2O3��s��+3CO��g��?2Fe��s��+3CO2��g��
��ʼ����mol�� 1 1
�仯����mol�� x x
ƽ������mol�� 1-x 1+x
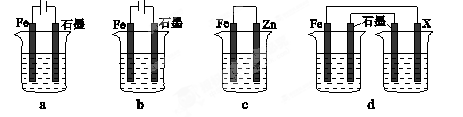
K= =
= =64������õ�x=0.6����ת����=60%
=64������õ�x=0.6����ת����=60%
��a����Ӧǰ�����������仯��������䣬�������������ܶȺ㶨ʱ����־��Ӧ�ﵽƽ��״̬����ȷ��b����������һ����̼���ӣ��൱������ѹǿ����Ӧǰ��������䣬��������CO��ƽ��ת���ʵ����ҵ�ת���ʴ���c����������ƽ��һ����̼���ʵ���Ϊ0.4mol���������н��ƽ�ⳣ������õ�����һ����̼Ϊ1.4mol��ƽ�����ʵ���Ϊ0.6mol������������CO��ƽ��Ũ��֮��Ϊ0.4+0.6=2��3����ȷ��d�����������Ӳ�Ӱ�컯ѧƽ�⣬����Fe2O3�������CO��ת���ʣ���d���ʴ�Ϊ��ac ��
��4����װ����ԭ��ص������͵��ص��������Եõ�������bc���Ա��������ʴ�Ϊ��bc��
��װ��Ϊԭ��أ�����dװ�ñ�������X���ĵ缫����Ӧ�������ÿ���ѡ��п��
���㣺���⿼���Ȼ�ѧ����ʽ��˹���ɼ���Ӧ�ã�ƽ�ⳣ������Ӧ�ã���ѧƽ������ʽ��ʽ���㷽����ԭ���ԭ���ķ����жϡ�


 ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
ij�жԴ������м��,���ָ�����Ҫ��Ⱦ��Ϊ�����������PM2.5(ֱ��С�ڵ���2.5��m������������),����Ҫ��ԴΪȼú��������β���ȡ����,��PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣
��ش���������:
(1)��PM2.5����������ˮ�����Ƴɴ���������
����ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±�:
| ���� | K+ | Na+ | N | S | N | Cl- |
| Ũ��/mol��L-1 | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
 O2(g) H2O(g) ��H="-241.8" kJ��mol-1 ��
O2(g) H2O(g) ��H="-241.8" kJ��mol-1 �� O2(g) CO(g)�� ��H="-110.5" kJ��mol-1 ��
O2(g) CO(g)�� ��H="-110.5" kJ��mol-1 �� 2NO(g)����H>0
2NO(g)����H>0�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
I���״���һ������ȼ�ϣ�������ȼ�ϵ�ء���ҵ�Ͽ����������ַ�Ӧ�Ʊ��״���
��֪��CO(g) + 2H2(g)  CH3OH(g) ��H1
CH3OH(g) ��H1
CO2(g) �� 3H2(g)  CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
2H2(g)+ O2(g)=2H2O(g) ��H3
��2CO(g)��O2(g)=2CO2(g) �ķ�Ӧ�Ȧ�H=____ ___���æ�H1����H2����H3��ʾ����
II����ҵ�Ͽ����á���������ת������������������ӦΪ��CH4(g)+H2O(g) CO(g)+3H2(g)��
CO(g)+3H2(g)��
��֪�¶ȡ�ѹǿ��ˮ̼��[n(H2O)/ n(CH4)]�Լ���ƽ�⺬����Ӱ������ͼ��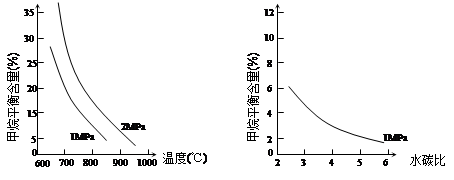
ͼ1��ˮ̼��Ϊ3�� ͼ2��800�棩
��1���¶ȶԸ÷�Ӧ�ķ�Ӧ���ʺ�ƽ���ƶ���Ӱ���� ��
��2�������������䣬����ͼ2�л���ѹǿΪ2 MPaʱ��CH4ƽ�⺬����ˮ̼��֮���ϵ���ߡ���ֻҪ�����µı仯���ߣ�
��3����֪����700�棬1MPaʱ��1mol CH4��1mol H2O��1L���ܱ������з�Ӧ��6���Ӵﵽƽ�⣬��ʱCH4��ת����Ϊ80%������6����H2��ƽ����Ӧ���ʺ��¶��·�Ӧ��ƽ�ⳣ���Ƕ��٣���д��������̣��������С�����һλ���֡���
III��ijʵ��С�������ͼa��ʾ�ĵ��װ�ã������ĵ缫��ӦʽΪ____ ____��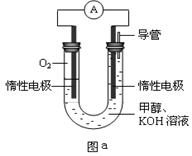
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
50 mL 0.50 mol��L-1������50 mL 0.55 mol��L-1 NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش���������: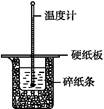
(1)��ʵ��װ���Ͽ�,ͼ����ȱ�ٵ�һ�ֲ�����Ʒ�� ��
(2)�ձ���������ֽ���������� ��
(3)���ձ����粻��Ӳֽ��,��õ��к�����ֵ (�ƫ��ƫС������Ӱ�족)��
(4)ʵ���и���60 mL 0.50 mol��L-1�����50 mL 0.55 mol��L-1 NaOH��Һ���з�Ӧ,������ʵ�����,���ų������� (���ȡ�����ȡ�)�������к��� (���ȡ�����ȡ�),��������: ��
(5)����ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ��,��õ��к��ȵ���ֵ�� ,��50 mL 0.50 mol��L-1 NaOH��Һ��������ʵ��,��õ��к��ȵ���ֵ�� (���ƫ��ƫС������Ӱ�족)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��֪����KI�����ᡢ�Լ�X�͵���������Һ��ϣ���Ӧ������
�������еμ�˫��ˮ��������Ӧ��H2O2+2H++2I��=2H2O+I2��
�����ɵ�I2�������Լ�X��Ӧ�����Լ�X����������ɵ� I2�Ż������۱�����ˣ������Լ�X����������˫��ˮ����Һ���������ʱ�䣬�������㣺H2O2+2H++2I��= 2H2O+I2�ķ�Ӧ���ʡ�
�±�Ϊijͬѧ��������ԭ����Ƶ�ʵ�鼰ʵ���¼����ʵ��������������½��У���
| ��� | ���ձ��м�����Լ�����������mL�� | ���� | ��ʼ����ʱ�䣨min�� | ||||
| 0��1 mol��L��1 KI��Һ | H2O | 0��01 mol��L��1 X��Һ | 0��1mol��L��1 ˫��ˮ | 1 mol��L1 ϡ���� | |||
| 1 | 20��0 | 10��0 | 10��0 | 20��0 | 20��0 | �� | 1��4 |
| 2 | 20��0 | m | 10��0 | 10��0 | n | �� | 2��8 |
| 3 | 10��0 | 20��0 | 10��0 | 20��0 | 20��0 | �� | 2��8 |
| 4 | 20��0 | 10��0 | 10��0 | 20��0 | 20��0 | 5��Fe2(SO4)3 | 0��6 |

 2AlI3(s)����I�������л�����ϳ�����Ϊ����ʣ��õ�ظ����ĵ缫��ӦΪ��________________________�����ʱAl���ӵ�Դ��___________����
2AlI3(s)����I�������л�����ϳ�����Ϊ����ʣ��õ�ظ����ĵ缫��ӦΪ��________________________�����ʱAl���ӵ�Դ��___________�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ڻ�ѧ��Ӧ���ȵ������У���ȷ����
| A����ѧ��Ӧ���ȶ���ͬ |
| B������ͨ���ı��¶ȿ��ƻ�ѧ��Ӧ���� |
| C������ͨ���ӳ���ѧ��Ӧ��ʱ��ı仯ѧ��Ӧ���� |
| D����һ����ѧ��Ӧ��һ�������´ﵽ��ʱ����Ӧ��ֹͣ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ڿ��淴Ӧ�������磩����£��� ��ã��磩����ģ��磩��Ӧ�����У�������������ʱ������ĵ����������ģ����¶ȣԻ�ѹǿp�Ĺ�ϵ��ͼ��ʾ�����ж�����˵����ȷ����
��ã��磩����ģ��磩��Ӧ�����У�������������ʱ������ĵ����������ģ����¶ȣԻ�ѹǿp�Ĺ�ϵ��ͼ��ʾ�����ж�����˵����ȷ����
| A�����£���ѧƽ��������Ӧ�����ƶ� |
| B��ʹ�ô�����ʹD%�������� |
| C����ѧ����ʽ������Ļ�ѧ��������>�𣫣� |
| D��B�Ŀ���ԽС������Ӧ����Խ�죬������ƽ��������Ӧ�����ƶ� |
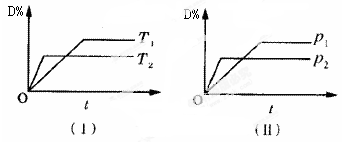
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ܱ������У����ڷ�Ӧ�� �����п�ʹ��ѧ��Ӧ��������Ĵ�ʩ�ǣ� ��
�����п�ʹ��ѧ��Ӧ��������Ĵ�ʩ�ǣ� ��
A����С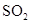 Ũ�� Ũ�� | B�������¶� | C������������� | D�������¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��2L�ܱ������н��еķ�Ӧ2SO2(g)��O2(g) 2SO3(g)����10���ڷ�Ӧ��SO2�����ʵ�����1mol����0.6mol����Ӧ���ʦ�(O2)Ϊ�� ��
2SO3(g)����10���ڷ�Ӧ��SO2�����ʵ�����1mol����0.6mol����Ӧ���ʦ�(O2)Ϊ�� ��
| A��0.02mol/(L��s) | B��0.04mol/((L��s) | C��0.01mol/((L��s) | D��0.2mol/((L��s) |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com