
对于可逆反应mA(g)+nB(s)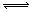 pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是
| A.降温,化学平衡向正反应方向移动 |
| B.使用催化剂可使D%有所增加 |
| C.化学方程式中气体的化学计量数m>p+q |
| D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
A
解析试题分析:从图Ⅰ可看出,其他条件不变时,采用T2温度,达到平衡所需时间比用T1温度短,即反应速率快,可见T2>T1,但采用高温(T2)达到平衡时,生成物的百分含量低,说明升温平衡向逆反应方向移动,反之,降温平衡向正反应方向移动,A正确。从图Ⅱ可看出其他条件不变时,采用p2的压强,比p1先达到平衡,所以p2>p1,但采用高压,达到平衡时,生成物减少,说明加压,平衡左移,正反应是气体体积增大的反应。m<p+q。所以C选项是错误的,催化剂不能改变物质的转化率,因此B选项是错误的。增大固体反应物的接触面积只能加快反应速率,对化学平衡移动没有影响,因此D选项是错误的
考点:考查影响化学平衡因素的相关知识点


科目:高中化学 来源: 题型:问答题
(14分)
以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质 )为原料回收MnO2的工艺流程如下:
I. 将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II. 将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV. 向III所得溶液(pH约为6)中缓慢滴加0.50 mol?L-1 Na2CO3溶液,过滤,得滤渣b,其主要成分为MnCO3;
V. 滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι中Ag与足量稀HNO3反应生成NO的化学方程式为 。
(2)已知II的灼烧过程中同时发生反应:
MnO2(s) + C(s) ="==" MnO(s) + CO (g) △H = +24.4kJ ? mol –1 ①
MnO2(s) + CO(g) ="==" MnO(s) + CO2(g) △H = -148.1 kJ ? mol –1 ②
写出MnO2和C反应生成MnO和CO2的热化学方程式: 。
(3)H2O2分子中含有的化学键类型为 、 。
(4)III中MnO2溶解的离子方程式为 ,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因: 。
(5)IV中,若改为“向0.50 mol?L-1 Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中会混有较多Mn(OH)2沉淀,解释其原因: 。
(6)V中MnCO3在空气中灼烧的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)
2Fe3O4(s) 6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
下列坐标图分别表示FeO的转化率(图-1 )和一定温度时,H2出生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图-2)。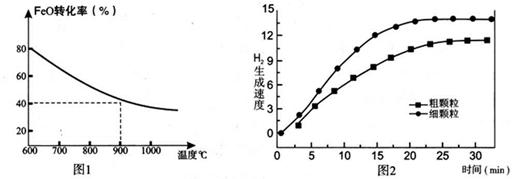
(1)反应:2H2O(g)=2H2(g)+O2(g) △H= (用含a、b代数式表示);
(2)上述反应b>0,要使该制氢方案有实际意义,从能源利用及成本的角度考虑,实现反应II可采用的方案是: ;
(3)900°C时,在两个体积均为2.0L密闭容器中分别投人0.60molFeO和0.20mol H2O(g)甲容器用细颗粒FeO、乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②细颗粒FeO时H2O(g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计箅过程,保留两位有效数字)。
(4)在下列坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注)。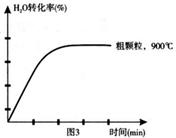
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知:
①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
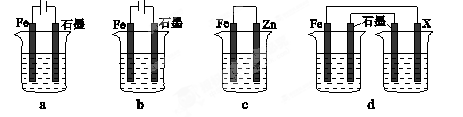
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)
|
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
影响化学反应速率与平衡的因素有多方面,如浓度压强温度催化剂等。下列有关说法不正确的是
| A.其它条件不变时,改变压强能改变气体反应的速率,但不一定改变平衡 |
| B.增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数 |
| C.温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数 |
| D.加入催化剂能降低反应所需的活化能,使反应速率加快,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。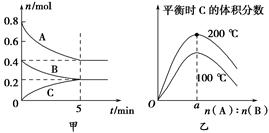
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,体积固定的密闭容器中,当下列物理量:①混合气体的压强 ② 气体的总物质的量 ③混合气体的密度 ④ B的物质的量浓度不再变化时,能表明可逆反应 A(s)+2B(g) 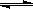 C(g)+D(g) 已达平衡的是 ( )
C(g)+D(g) 已达平衡的是 ( )
| A.①② | B.③④ | C.①④ | D.只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下的恒容容器中,标志反应A(s)+2B(g) 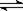 C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
| A.混合气体的压强不随时间变化而变化 |
| B.混合气体的密度不随时间变化而变化 |
| C.气体总物质的量不随时间变化而变化 |
| D.单位时间内生成n mol C,同时消耗2n mol B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com