
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源:不详 题型:单选题
| A.②③④⑥ | B.④⑤⑥ | C.①②④⑥ | D.②③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.PH=3的盐酸和PH=11的氨水等体积混合 |
| B.PH=3的盐酸和PH=11的氢氧化钡等体积混合 |
| C.PH=3的醋酸和PH=11的氢氧化钡等体积混合 |
| D.PH=3的硫酸和PH=11的氨水等体积混合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.固体CH3COOK | B.固体CH3COONH4 | C.气体NH3 | D.固体NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将煤液化、气化,提高燃料的燃烧效率 |
| B.在汽车上安装汽车尾气催化转化装置,使之发生反应: 2CO+2NO 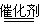 2CO2+N2 2CO2+N2 |
| C.在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢氧燃料电池汽车 |
| D.在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.V(酸)=102V(碱) | B.V(碱)=102V(酸) |
| C.V(酸)=2V(碱) | D.V(碱)=2V(酸) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制标准溶液的固体NaOH中混有杂质KOH |
| B.滴定终点读数时,俯视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com