
【题目】在周期表中,下列各组元素位于同一主族的是
A. H、Na B. Mg、Al C. N、Si D. S、Cl
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g) +nB(g)![]() cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )

A. 在恒温恒容条件下,向已达到平衡的体系中加入少量Z,平衡正向移动,Z的含量增大
B. 升高温度,正、逆反应速率都增大,平衡常数增大
C. △H <0 m + n > c
D. △H >0 m +n < c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1。

根据图示的分子结构和有关数据估算该反应的ΔH为 。
(2)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(白磷,s)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+![]() O2(g)===
O2(g)===![]() P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
相同状况下,能量较低的是 ;白磷的稳定性比红磷 (填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
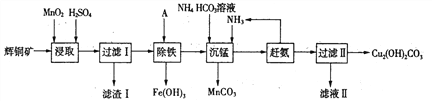
①浸取反应中氧化剂的化学式为________;滤渣I的成分为Mn02、S和_______(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2] =2.2×l0-20。)
③“沉锰”(除Mn2+)过程中反应的离子方程式___________。
④滤液Ⅱ经蒸发结晶得到的盐主要是________(写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装寘,盐桥内装载的是足量用饱和氯ft钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00g,则导线中通过了___mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差________g。
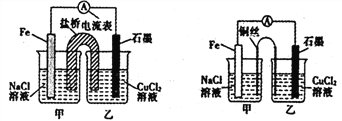
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH ___(填“减小”、“增大”或“不变”),乙池中石墨为___极(填“正”、“负”、“阴”或“阳”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B. 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
C. 氢氧化钠溶液吸收足量SO2气体:SO2 + 2OH-=SO32- + H2O
D. 标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2—=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 分馏石油可以得到植物油、柴油、润滑油
B. 在酒化酶的作用下葡萄糖水解为乙醇和二氧化碳
C. 乙酸、汽油、纤维素均能和氢氧化钠溶液反应
D. 在大豆蛋白溶液中,加入硫酸铜溶液,蛋白质会发生变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键与晶体结构说法正确的是( )
A. 共价键的键能越大,分子晶体的熔、沸点越高
B. 离子化合物的熔点一定比共价化合物的高
C. 非金属元素组成的化合物一定是共价化合物
D. 含有阴离子的化合物一定含有阳离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com