
【题目】相同质量的下列气体中电子数最少的是( )
A.O2 B.Cl2 C.N2 D.CO2
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )
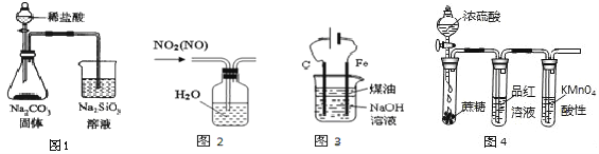
A.用图1实验可证明非金属性Cl>C>Si
B.用图2所示装置可除去NO2中的NO
C.用图3装置制备Fe(OH)2并能较长时间观察其颜色
D.图4实验装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F六种元素中,除F外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 其形成的一种同位素原子在考古中可推测化石的年代 |
B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
C | 地壳中含量最多的元素 |
D | D原子的内层电子数是最外层电子数的5倍 |
E | 其单质主要存在于火山口附近 |
F | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
请回答下列问题:
(1)A在元素周期表中的位置是_______________;A与C形成的化合物AC2的电子式是__________。
(2) 下列事实能证明C和E的非金属性强弱的是 。(填序号)
①常温下,C的单质呈气态,E的单质呈固态
②C的气态氢化物的稳定性强于E的气态氢化物的稳定性
③C与E形成的化合物中,E呈正价
④E的氢化物的沸点高于C的氢化物的沸点
(3) 由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是 (填化学式),它与足量NaOH溶液在加热时反应的离子方程为: 。
(4) FC与足量B的最高价氧化物的水化物的稀溶液反应的离子方程式 。若有标准状况下5.6L的BC生成,则转移的电子数为 。
(5) A的氢化物有多种,1 mol A的某种氢化物分子中含有14 mol电子,已知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40 kJ,写出表示该氢化物燃烧热的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向容积固定不变的密闭容器内充入a mol NO2,发生如下反应:2NO2 (g)![]() N2O4 (g) ,则达到平衡后,再向该容器内充入a mol NO2,达新平衡后与原平衡比较不正确的是 ( )
N2O4 (g) ,则达到平衡后,再向该容器内充入a mol NO2,达新平衡后与原平衡比较不正确的是 ( )
A.平均相对分子质量增大 B.NO2的质量分数增大
C.颜色变深 D.反应放出的总热量大于原平衡的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3的比较中,下列说法不正确的是( )
A.NaHCO3固体受热容易分解,而Na2CO3固体受热不容易分解
B.等质量的Na2CO3和NaHCO3分别与足量同浓度的盐酸反应,前者消耗盐酸的量比后者多
C.等物质的量浓度的Na2CO3和NaHCO3溶液中分别滴加2滴酚酞溶液,前者颜色比后者深
D.Na2CO3溶液和NaHCO3溶液分别与Ba(OH)2溶液反应的离子方程式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,不能适用于下列可逆反应的是
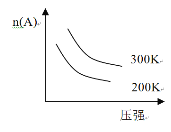
A.3A(g)+B(g)![]() 2C(g);ΔH<0
2C(g);ΔH<0
B.A(g)+3B(s)+2C(g)![]() 3D(g);ΔH<0
3D(g);ΔH<0
C.C(s)+D(g)![]() A(g)+B(g)ΔH>0
A(g)+B(g)ΔH>0
D.2C(g)![]() 2A(g)+B(g)ΔH>0
2A(g)+B(g)ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() (△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
⑴反应的化学方程式中a∶b∶c为;
⑵A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为;
⑶B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是,其值是;
⑷由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
⑸比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低;T2T3(填“<”“>”“=”)判断的理由是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气的物质的量为2摩尔
B.2摩尔水的摩尔质量是1摩尔水的摩尔质量的2倍
C.25 ℃,1.01×105Pa, 64g的SO2中含有的原子数为3NA
D.l摩尔任何物质所含的分子数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知还取性:SO32->I-。向含有amolKI和amolK2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
A. 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl-
B. 当 5a="4b" 时,发生的离子反应为 4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl-
C. 当 a≤b≤![]() 时,反应中转移电子的物质的量n(e-)为 amol≤n(e-)≤3amol
时,反应中转移电子的物质的量n(e-)为 amol≤n(e-)≤3amol
D. 当a<b<![]() 时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b
时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com