
【题目】V2-、W3-、X2+、Y2-、Z-是由短周期元素形成的简单离子,其中V2-、W3-、X2+均是10电子的微粒,Y2-、Z-与Ar原子具有相同的电子数。(请用化学用语回答下列问题)
(1)V2-的结构示意图为___________。
(2)V、W、X的原子半径由小到大的顺序是______________________。
(3)无水W2H4为无色液体,在298k时与V2气体迅速反应生成W2气体和液态的V的最简单氢化物,若生成1mol该液态氢化物放出311.2kJ热量,则该反应的热化学方程式为_________________________________。
(4)YZ2是一种重要的化工产品,熔点:-78℃,沸点:59.6℃,加热至40℃以上,部分开始分解,YZ2晶体属于___________晶体。
(5)①Na2YO3溶液中离子浓度从大到小的顺序是_________________________。
②已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,请通过计算确定NaHYO3水溶液的酸碱性(请写出计算过程)_________________________________。
【答案】![]() O N Mg N2H4(l)+ O2(g)=N2(g)+2H2O(l)△H=-622.4kJ/mol 分子 c(Na+)>c (SO32-)>c(OH-)> c(HSO3-)>c(H+) NaHSO3中HSO3-的水解常数Kh=Kw/ Ka1=
O N Mg N2H4(l)+ O2(g)=N2(g)+2H2O(l)△H=-622.4kJ/mol 分子 c(Na+)>c (SO32-)>c(OH-)> c(HSO3-)>c(H+) NaHSO3中HSO3-的水解常数Kh=Kw/ Ka1=![]() ≈7.1×10-13,因为HSO3-的电离常数为6.3×10-8,大于Kh,所以HSO3-在溶液中以电离为主,NaHSO3溶液显酸性。
≈7.1×10-13,因为HSO3-的电离常数为6.3×10-8,大于Kh,所以HSO3-在溶液中以电离为主,NaHSO3溶液显酸性。
【解析】
V2-、W3-、X2+均是10电子的微粒,确定V为氧元素、W为氮元素、X为镁元素;Y2-、Z-与Ar原子具有相同的电子数,确定Y为硫元素、Z为氯元素。
(1)O2-的结构示意图为![]() ;
;
正确答案:![]() 。
。
(2)微粒半径变化规律①电子层数越多,半径越大②电子层数相同时,核电荷数越大,吸电子能力越强,半径越小。所以V、W、X的原子半径由小到大的顺序是O、N、Mg;
正确答案:O、N、Mg。
(3)无水N2H4(l)与O2(g)迅速反应生成N2(g)和液态的H2O,若生成1mol该液态氢化物放出311.2kJ热量,则该反应的热化学方程式为N2H4(l)+ O2(g)=N2(g)+2H2O(l) △H=-622.4kJ/mol;
正确答案:N2H4(l)+ O2(g)=N2(g)+2H2O(l) △H=-622.4kJ/mol。
(4)SCl2是一种重要的化工产品,熔沸点低,所以SCl2晶体属于分子晶体;
正确答案:分子。
(5)①根据多元弱酸根(1)少量水解(2)分步水解,第一步为主;确定Na2SO3溶液中离子浓度从大到小的顺序是c(Na+)>c (SO32-)>c(OH-)> c (HSO3-)>c(H+);
正确答案:c(Na+)>c (SO32-)>c(OH-)> c (HSO3-)>c(H+)。
②NaHSO3中HSO3-的水解常数Kh=Kw/ Ka1=![]() ≈7.1×10-13,因为HSO3-的电离常数为6.3×10-8,大于Kh,所以HSO3-在溶液中以电离为主,NaHSO3溶液显酸性;
≈7.1×10-13,因为HSO3-的电离常数为6.3×10-8,大于Kh,所以HSO3-在溶液中以电离为主,NaHSO3溶液显酸性;
正确答案:NaHSO3中HSO3-的水解常数Kh=Kw/ Ka1=![]() ≈7.1×10-13,因为HSO3-的电离常数为6.3×10-8,大于Kh,所以HSO3-在溶液中以电离为主,NaHSO3溶液显酸性。
≈7.1×10-13,因为HSO3-的电离常数为6.3×10-8,大于Kh,所以HSO3-在溶液中以电离为主,NaHSO3溶液显酸性。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组设计的用化学电源使LED灯发光,装置如下。下列说法错误的是

A.铜片表面有气泡生成B.装置中存在“化学能→电能→光能”的转换
C.电子由锌片→稀硫酸→铜片D.电解质溶液中,阳离子移向铜片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.含有共价键的化合物可能是共价化合物
B.在共价化合物中可能存在离子键
C.含有离子键的化合物中一定是没有共价键
D.难失电子的原子,获得电子的能力一定强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液的pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法错误的是
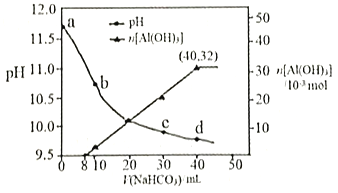
A. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+c(OH-)
B. 水的电离程度:a点小于c点
C. 原 NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8mol·L-1
D. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1Na2SO3溶液的pH约为10;0.1mol·L–1NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
A. 0.5mol·L-1·min-1B. 1mol·L-1·min-1
C. 2mol·L-1·min-1D. 3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用甲和乙通过化合反应制备丙,如图是三种分子的模型图,根据微观示意图得出的结论错误的是
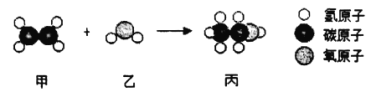
A. 甲的化学式为C2H4
B. 乙和丙都属于氧化物
C. 化学反应前后分子的种类都发生了改变
D. 保持乙化学性质的最小微粒是水分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com