
【题目】工业上用甲和乙通过化合反应制备丙,如图是三种分子的模型图,根据微观示意图得出的结论错误的是
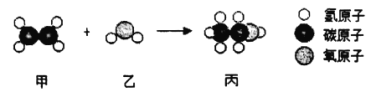
A. 甲的化学式为C2H4
B. 乙和丙都属于氧化物
C. 化学反应前后分子的种类都发生了改变
D. 保持乙化学性质的最小微粒是水分子
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示装置制备一硝基甲苯。

实验步骤如下:
①配制浓硫酸和浓硝酸(按体积比1∶3)的混合物(混酸);
②在三颈瓶里装15 mL甲苯;
③装好其他药品,并组装好仪器;
④向三颈瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈瓶底有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯。(已知:甲苯的密度为0.866 g·cm-3,沸点为110.6 ℃;硝基苯的密度为1.20 g·cm-3,沸点为210.9 ℃)
根据上述实验,回答下列问题:
(1)实验方案中缺少一个必要的仪器,它是________。本实验的关键是控制温度在30 ℃左右,如果温度过高,产生的后果是__________________________。
(2)简述配制混酸的方法:________________________________,浓硫酸的作用是_________________。
(3)L仪器名称是________,进水口是________。
(4)写出甲苯与混酸反应生成对硝基甲苯的化学方程式:______________,反应类型为:________。
(5)分离产品方案如下:

操作1的名称是________。
(6)经测定,产品1的核磁共振氢谱中有3个峰,则其结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法错误的是
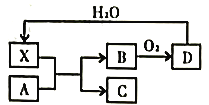
A. X使蔗糖变黑的现象主要体现了X的脱水性
B. 若A为铁,则在图中的反应,X只起氧化的作用
C. 若A为碳单质,则C不宜用来扑灭由钠引起的着火
D. 将B气体通入品红溶液中,品红溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V2-、W3-、X2+、Y2-、Z-是由短周期元素形成的简单离子,其中V2-、W3-、X2+均是10电子的微粒,Y2-、Z-与Ar原子具有相同的电子数。(请用化学用语回答下列问题)
(1)V2-的结构示意图为___________。
(2)V、W、X的原子半径由小到大的顺序是______________________。
(3)无水W2H4为无色液体,在298k时与V2气体迅速反应生成W2气体和液态的V的最简单氢化物,若生成1mol该液态氢化物放出311.2kJ热量,则该反应的热化学方程式为_________________________________。
(4)YZ2是一种重要的化工产品,熔点:-78℃,沸点:59.6℃,加热至40℃以上,部分开始分解,YZ2晶体属于___________晶体。
(5)①Na2YO3溶液中离子浓度从大到小的顺序是_________________________。
②已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,请通过计算确定NaHYO3水溶液的酸碱性(请写出计算过程)_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuC1)在化工、印染、电镀等行业应用广泛。CuCl微溶于水,不溶于醇和稀酸,可溶于Cl-浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuC1的工艺过程如图所示:

回答下列问题:
(1)步骤①中N元素被还原为最低价,写出此反应的离子方程式___________。
(2)步骤②中,亚硫酸铵要略保持过量,原因是___________,滤液中可循环利用的物质是___________。
(3)步骤⑤中,醇洗的目的是______________________。
(4)常用K2Cr2O7溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品10.00g,将其置于过量的FeCl2溶液中,待样品完全溶解后,加入适量稀硫酸配成100mL溶液,取溶液10.00mL用0.1000mol·L K2Cr2O7溶液进行滴定,反应中Cr2O72-被还原成Cr3+,相关数据记录如下表所示:
实验编号 | 1 | 2 | 3 |
消耗K2Cr2O7溶液的体积/mL | 14.98 | 16.03 | 15.02 |
该样品中CuCl的质量分数___________。(保留4位有效数字)
(5)制造印刷电路板产生的废液中含大量[Cu(NH3)4]2+等离子,利用膜电解技术对此废液进行电解,电解装置如下图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到CuCl,电解时阴极的电极反应式为___________,生成CuCl的离子方程式为______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知

A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. pH值小于7的雨水称为酸雨B. 工厂将烟囱造高能减小对环境的污染
C. 全球气温变暖是因为SO2的大量排放D. 油电混动车的大量推广可减轻环境的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将AgCl分别加入盛有:①5 mL水;② 6 mL0.5mol·L-1 NaCl溶液;③10 mL0.2mol·L-1 CaCl2溶液;④50 mL0.1mol·L-1盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
A. ④③②① B. ②③④① C. ①④③② D. ①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中部分元素在周期表中的位置如图所示。一个WX2分子中含有22个电子,Y的质子数是X、Z的核电荷数之和的—半。下列说法正确的是
W | X | |
Z |
A. 非金属性:W < Z
B. 简单离子的半径:X2- < Y2+
C. 沸点:H2X < H2Z
D. WX2的电子式为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com