
| A. | 溶液中可能发生反应Z2+2A2+=2A3++2Z- | |
| B. | Z2在①③反应中作还原剂 | |
| C. | 氧化性强弱顺序为XO4->Z2>B2>A3+ | |
| D. | X2+是XO4-的还原产物 |
分析 ①16H++10Z-+2XO4-═2X2++5Z2+8H2O中,Z元素的化合价升高,X元素的化合价降低;
②2A2++B2═2A3++2B-中,A元素的化合价升高,B元素的化合价降低;
③2B-+Z2═B2+2Z-中,B元素的化合价升高,Z元素的化合价降低,则
A.若发生反应Z2+2A2+=2A3++2Z-,氧化性Z2>A3+,与②③中结论一致;
B.①中Z元素的化合价升高,③中Z元素的化合价降低;
C.氧化剂的氧化性大于氧化产物的氧化性;
D.①中X得到电子被还原.
解答 解:①16H++10Z-+2XO4-═2X2++5Z2+8H2O中,Z元素的化合价升高,X元素的化合价降低;
②2A2++B2═2A3++2B-中,A元素的化合价升高,B元素的化合价降低;
③2B-+Z2═B2+2Z-中,B元素的化合价升高,Z元素的化合价降低,则
A.氧化剂的氧化性大于氧化产物的氧化性,则氧化性XO4->Z2>B2>A3+,可发生反应Z2+2A2+=2A3++2Z-,氧化性Z2>A3+,故A正确;
B.①中Z元素的化合价升高,③中Z元素的化合价降低,分别作还原剂、氧化剂,故B错误;
C.氧化剂的氧化性大于氧化产物的氧化性,则氧化性XO4->Z2>B2>A3+,故C正确;
D.①中X得到电子被还原,则X2+是XO4-的还原产物,故D正确;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、基本概念为解答的关键,侧重分析与应用能力的考查,注意氧化性的比较方法,题目难度不大.


科目:高中化学 来源: 题型:填空题
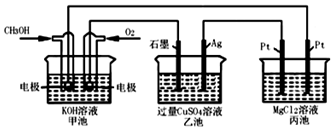
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的能量一定高于M,Y的能量一定高于N | |
| B. | 因该反应为放热反应,故不必加热就可以发生 | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 破坏反应物中的化学键所吸收的能量大于形成生成物中的化学键所放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 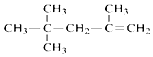 的名称为:2,4,4-三甲基-1-戊烯 的名称为:2,4,4-三甲基-1-戊烯 | |
| B. | 乙酸、葡萄糖、淀粉的最简式均为CH2O | |
| C. | 醛基的电子式: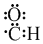 | |
| D. | 乙醇分子比例模型: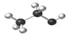 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 成分 | SiO2 | MgO | Fe2O3 | Al2O3 | CuO |
| 质量分数(%) | ? | 4.0 | 32 | 10.2 | 16 |
| Cu(OH)2 | Mg(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀的pH | 4.8 | 9.3 | 2.7 | 3.8 |
| 完全沉淀的pH | 6.4 | 10.8 | 3.7 | 4.7 |
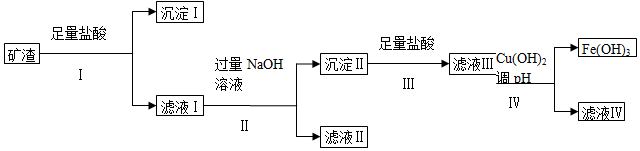
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取25 g CuSO4•5H2O溶于1 L水中 | |
| B. | 取16 g CuSO4•5H2O溶于少量水中,再稀释至1 L | |
| C. | 取16 g无水CuSO4溶于1 L水中 | |
| D. | 取25 g CuSO4•5H2O溶于水配成1 L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol | B. | 0.25mol | C. | 0.1mol | D. | 0.125mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
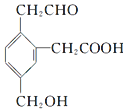 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤⑦ | D. | ②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com