

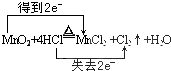
 .
.分析 本题为氯气的制备和性质检验,装置A为发生装置,依据浓盐酸的挥发性可知制取的氯气中含有氯化氢和水蒸气,依次通过洗气瓶B、C除去氯化氢和水蒸气,干燥的氯气与铁在D中发生氧化反应生成氯化铁,氯气有毒需要进行尾气处理,F为吸收过量氯气装置.
(1)B处为气体的净化装置,为洗气瓶,应长进短出;
(2)依据浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,据此选择饱和食盐水除去氯化氢,依据浓硫酸具有吸水性,与氯气不反应选择浓硫酸干燥氯气;
(3)铁在氯气中燃烧生成氯化铁;
(4)在MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合价降低,1mol二氧化锰反应转移2mole-,据此用双线桥表示氧化还原反应电子转移,依据方程式计算消耗二氧化锰、被氧化的氯化氢的物质的量;
解答 解:(1)B处为气体的净化装置,为洗气瓶,应长进短出;
故选:B;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,所以可以用盛有饱和食盐水的洗气瓶除去氯化氢,浓硫酸具有吸水性,能够干燥氯气,除去氯气中的水蒸气;
故答案为:氯化氢;饱和食盐水;水蒸气;
(3)铁在氯气中燃烧生成氯化铁,化学方程式:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(4)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合价降低,氧化剂为MnO2,1mol二氧化锰反应转移2mole-,用双线桥法表示反应中电子转移的数目为: ;
;
A中产生氯气3.36L(标准状况),物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,
依据方程式可知:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
1 4 1
n(MnO2)n(HCl ) 0.15mol
解得消耗的二氧化锰的物质的量n(MnO2)=0.15mol;
消耗的氯化氢的物质的量n(HCl )=0.6mol,其中只有一半被氧化,则被氧化的HCl的物质的量0.3mol;
故答案为: ;0.15mol;0.3mol;
;0.15mol;0.3mol;
点评 本题考查了氯气的制备及性质检验,明确氯气制备原理和各装置作用是解题关键,注意氧化还原反应基本概念,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.0mol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+2 c(CO32-)=1.0mol/L | |
| B. | 1.0mol/L Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、HCO3-、Cl- | B. | Fe3+、SCN-、Cl-、NO3- | ||
| C. | Mg2+、Cu2+、SO42-、NO3- | D. | Fe2+、SO42-、H+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释Na2CO3溶液时,C(HCO3-)、$\frac{C(O{H}^{-})}{C(C{{O}_{3}}^{2-})}$均增大 | |
| B. | 常温下,反应4Fe(OH)2(s)+2H2O(I)+O2(g)=4Fe(OH)3(s)的△H<0,△S>0 | |
| C. | 用0.1mol•L-1CH3COOH溶液滴定0.1mol•L-1 NaOH至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+) | |
| D. | 向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可作调味剂,也可用作食品防腐剂 | |
| B. | 二氧化硫可用于制作葡萄酒的食品添加剂 | |
| C. | 还原铁粉和生石灰均可用作食品包装袋内的脱氧剂 | |
| D. | “地沟油”禁止食用,但可用来制取肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其它条件不变时,使用高效催化剂,不可以使NO的转化率增大 | |
| B. | 平衡时,其它条件不变,充入NH3,平衡向右移动,NH3的转化率增大 | |
| C. | 当混合气体的密度不变了,则反应达到化学平衡状态 | |
| D. | 平衡时,其它条件不变,升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 除④⑥⑦以外 | C. | ③④⑤⑥ | D. | ②⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com