
【题目】如图是实验室制备纯净氯气的实验装置,试回答下列问题:
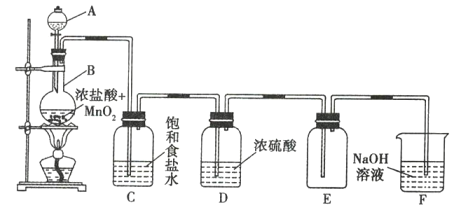
(1)写出下列仪器的名称:A __________________ ,B ________________ 。
(2)写出制备氯气的反应的离子方程式: __________________ 。
(3)装置C的作用是 __________________ ,装置D的作用是 __________________ 。
(4)装置F的作用是 __________________ (用化学方程式表示)。
(5)实验结束时,需要先撤去B与C之间的导管,然后再撤掉酒精灯。若先撤掉酒精灯,而不撤去B与C之间的导管,则会导致 __________________ 。
【答案】分液漏斗 圆底烧瓶 ![]() 除去
除去![]() 中的HCl除去
中的HCl除去 ![]() 中的水蒸气
中的水蒸气 ![]() 装置C、D、F中的液体依次发生倒吸
装置C、D、F中的液体依次发生倒吸
【解析】
MnO2和HCl反应制备的Cl2中含有HCl、H2O等杂质,利用饱和食盐水除去HCl,利用浓硫酸除去H2O,E用于收集氯气,F用于尾气吸收。
(1)根据仪器的结构![]() A为分液漏斗,
A为分液漏斗,![]() B为圆底烧瓶;
B为圆底烧瓶;
(2)制备氯气的反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)装置C中的饱和食盐水可除去Cl2中的HCl;装置D中的浓硫酸可除去Cl2中的水蒸气;(4)装置F中盛有碱液,可以吸收多余的Cl2,使之转化为NaCl、NaClO,化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O;
(5)若只撤掉酒精灯,则装置内气体冷却会导致倒吸。答案为装置C、D、F中的液体依次发生倒吸。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以黄铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
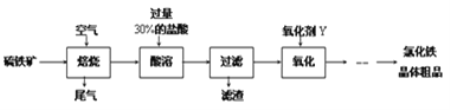
请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是______________________________________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是_____________、__________.
(3)尾气主要含N2、O2、SO2和少量的CO2、H2O(g).测定尾气中SO2含量的方案如下:
(方案甲)将标准状况下的2.24 L尾气缓慢通过如下装置A中:
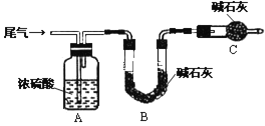
①C仪器的名称是_______________,装置C的作用是_________________________.
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,请写出该方案合理与否的理由__________________________________________.
(方案乙)将标准状况下的2.24 L尾气缓慢通过如下装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、用电子天平称得沉淀质量为0.233g.
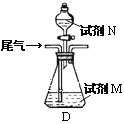
③若试剂M、N分别是碘水、BaCl2溶液,写出D中总反应的离子方程式: __________________.尾气中SO2的体积分数为__________________.
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色.写出SO2和Ba(NO3)2溶液反应的离子方程式:___________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为_____。
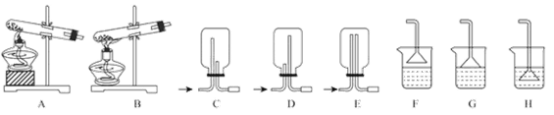
(2)按下图装置进行NH3性质实验。
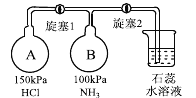
①先打开旋塞1,B瓶中的现象是_______,原因是__________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是_________________。
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响。
限制试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究______对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中V(溶液)表示所配制溶液的体积)。_________________
物理量 | V(溶液)/mL | …… | |||
1 | 100 | ||||
2 | 100 |
③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应得平衡转化率
为_____(只列出算式,忽略水自身电离的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1∶1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产生等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与O2
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊溶液中,溶液先变蓝,后褪色
A.①③⑥⑧B.③⑦⑧
C.②⑤⑥⑦D.①④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9C)与Cl2 反应制备SnCl4装置如下图所示。
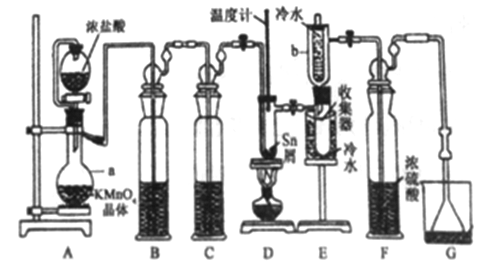
已知,① SnCl4在空气中极易水解生成SnO2xH2O;②SnCl2、SnCl4有关物理性质如下表。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
回答下列问题:
(1)仪器a的名称是__________,其中发生反应的离子方程式为________。
(2)装置B、C 中盛装的试剂分别是_______、__________。
(3)当观察到装置F液面上方出现_____现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的有:①加快氯气与锡反应,②__________。
(4)E装置中b的作用是___________。
(5)若制得产品中含有少量Cl2,则可采用下列_____(填字母)措施加以除去。
A.加入NaOH 萃取分液 B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤 D.加入饱和食盐水萃取
(6)可用滴定法测定最后产品的纯度。准确称取该样品mg加入到适量浓盐酸溶解,然后再加水稀释至250 mL,用移液管移取25.00 ml,稀释后的溶液于锥形瓶中,加入两滴淀粉溶液作指示制,用cmol/L 的KIO3 标准溶液进行滴定,平行滴定3 次,平均消耗V mL的标准溶液。已知滴定时发生的反应为:Sn2++IO3-+H+→Sn4++I2+H2O(未配平)。回答下列问题:
①判断达到滴定终点的现象为____________。
②产品中SnCl2(摩尔质量为M g/mol )的含量为____%(用含m、c、V、M 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧钒![]() 碱式碳酸铵
碱式碳酸铵![]() 难溶于水
难溶于水![]() 化学式为
化学式为![]() ,它是制备热敏材料
,它是制备热敏材料![]() 的原料。
的原料。![]() 价钒在弱酸性条件下具有还原性。一种制备氧钒
价钒在弱酸性条件下具有还原性。一种制备氧钒![]() 碱式碳酸铵方案如下:
碱式碳酸铵方案如下:
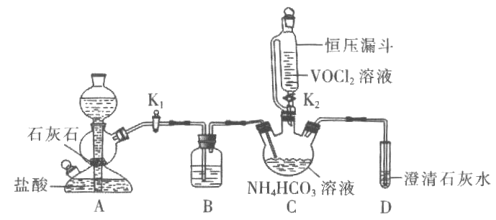
请回答下列问题:
(1)![]() 装置盛装的试剂是________
装置盛装的试剂是________![]() 填名称
填名称![]() 。A中反应的离子方程式为________。相对分液漏斗,恒压漏斗优点是________。
。A中反应的离子方程式为________。相对分液漏斗,恒压漏斗优点是________。
(2)实验时,先关闭![]() ,打开
,打开![]() ,当________
,当________![]() 填实验现象
填实验现象![]() 时,后________
时,后________![]() 填实验操作
填实验操作![]() 。
。
(3)实验完毕后,从C装置中分离产品的操作方法是________![]() 填操作名称
填操作名称![]() 。
。
(4)测定粗产品中钒的含量。实验步骤如下:
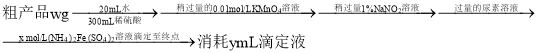
已知:滴定反应为![]()
![]() 该粗产品中钒的质量分数的表达式为________
该粗产品中钒的质量分数的表达式为________![]() 。
。
![]() 若滴定前仰视读数,终点时俯视读数,则测得结果________填“偏高”、“偏低”或“无影响”
若滴定前仰视读数,终点时俯视读数,则测得结果________填“偏高”、“偏低”或“无影响”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL0.40molL-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6min时,c(H2O2)=0.30mol·L-1
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2和0.030molO2放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
①从平衡角度分析采用过量O2的目的是___。
②该条件下反应的平衡常数K=___。
③已知:K(300℃)>K(350℃),正反应是___(填“吸”或“放”)热反应。若反应温度升高,SO2的转化率___(填“增大”“减小”或“不变”)。
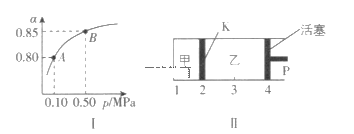
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图I所示。平衡状态由A变到B时,平衡常数K(A)___K(B)(填“大于”“等于”或“小于”,下同)。
(3)如图II所示,保持温度不变,将2molSO2和1molO2加入甲容器中,将4molSO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲___乙。
②若保持乙中压强不变,向甲、乙容器中通人等质量的氦气,达到新平衡时,SO3的体积分数甲___乙。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com