
【题目】金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO。
(1) Ca元素在周期表中位置是____,其原子结构示意图____。
(2) Ca与最活跃的非金属元素A形成化合物D,D的电子式为____,D的沸点比A与Si形成的化合物E的沸点____。
(3)配平用钙线氧脱鳞的化学方程式____:P+FeO+CaO![]() Ca3(PO4)2+Fe。
Ca3(PO4)2+Fe。
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为______;检测Mn+的方法是_____(用离子方程式表达)。
(5)取1.6 g钙线试样,与水充分反应,生成224 mL H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3____g。
【答案】第四周期ⅡA族 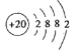
![]() 高 2P+5FeO+3CaO
高 2P+5FeO+3CaO![]() Ca3(PO4)2+5Fe Fe Fe3++3SCN-=Fe(SCN)3 1.1
Ca3(PO4)2+5Fe Fe Fe3++3SCN-=Fe(SCN)3 1.1
【解析】
(1)Ca元素为20号元素,在周期表中位置为第四周期ⅡA族;
(2)最活跃的非金属元素A为F,与Ca反应生成CaF2;离子化合物的沸点比分子晶体高;
(3)根据化合价升降法配平;
(4)白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的物质为Fe(OH)3,可用KSCN验证Fe3+的存在;
(5)钙线试样中,根据Ca守恒计算。
(1)Ca元素为20号元素,在周期表中位置为第四周期ⅡA族,原子结构示意图为 ;
;
(2)最活跃的非金属元素A为F,与Ca反应生成CaF2,其电子式为![]() ;CaF2为离子化合物,SiF4为分子晶体,则CaF2的沸点高;
;CaF2为离子化合物,SiF4为分子晶体,则CaF2的沸点高;
(3)根据化合价升降法,P由0价变为+5价,Fe由+2价变为0价,磷酸根离子角标为2,则最小公倍数为10,则P的系数为2,FeO的系数为5,其它根据原子守恒配平,方程式为2P+5FeO+3CaO![]() Ca3(PO4)2+5Fe;
Ca3(PO4)2+5Fe;
(4)白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的物质为Fe(OH)3,则金属M为Fe;Fe3++3SCN-=Fe(SCN)3溶液颜色变为血红色,可用KSCN验证Fe3+的存在;
(5) 钙线试样中,Ca与水反应生成氢气,224 mL H2(标准状况),为0.01mol,则生成0.01mol的Ca(OH)2,已知钙线式样中CaO含量为3.5%,1.6![]() 3.5%/56=0.001mol,则溶液中生成0.011mol的Ca(OH)2,可得到0.011mol的碳酸钙,即1.1g。
3.5%/56=0.001mol,则溶液中生成0.011mol的Ca(OH)2,可得到0.011mol的碳酸钙,即1.1g。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】现用Na2SO4固体来配制480mL0.2mol·L-1的Na2SO4溶液。可供选择的仪器如图:
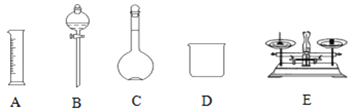
(1)如图所示的仪器中配制溶液不需要的是__ (填选项),配制上述溶液还需用到的玻璃仪器是___、__ (填仪器名称)。
(2)使用容量瓶之前必须进行的操作是___。(填选项)
A.检查气密性 B.检查是否漏水 C.烘干
(3)经计算,需Na2SO4的质量为___g。
(4)你选用的容量瓶规格为___mL。
(5)配制溶液时,一般可分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容
其操作顺序:②→__→__→__→__→__→__(填序号)。___
(6)在配制过程中,其他操作都准确,定容时俯视刻度线会使所配溶液浓度__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某校化学实验兴趣小组为了验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),请按要求回答下列问题。
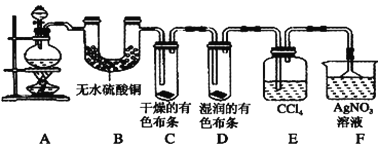
(1) 实验室制备Cl2所用的化学药品是________。
写出该反应的离子方程式,并用单线桥表示电子转移情况_____________________ ,此反应中每转移0.8mol电子,消耗Hcl____mol
(2)①装置B的作用是_______
②装置C和D出现的不同现象说明的问题是___
③装置E的作用是_______
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置___与___之间(填装置字母序号)增加一个装置,所增加装置里面的试剂可以为___(填字母序号)。
A.湿润的碘化钾淀粉试纸 B.浓硫酸 C.湿润的红色布条 D.饱和食盐水
Ⅱ.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为:_____________。
②漂白粉的有效成分是________________________。
③漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A. 在煤中添加石灰石作脱硫剂
B. 将废弃塑料热裂解处理,可获得乙烯、丙烯等化工原料
C. 用催化法处理汽车尾气中的CO和NO:CO+NO![]() C+NO2
C+NO2
D. 利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花中能提取出有很高药用价值的绿原酸(如图所示),下列说法不正确的是( )
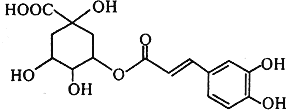
A. 绿原酸分子中有3个手性碳原子
B. 绿原酸能发生取代、加成、消去和氧化反应
C. 1mol绿原酸与NaOH溶液反应,最多消耗4mol NaOH
D. 绿原酸水解的一种产物能与FeCl3发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1mol/L①CH3COOH、②NaOH、③CH3COONa,下列叙述正确的是( )
A.①中[CH3COOH]>[CH3COO-]>[H+]>[OH-]
B.①②等体积混合后,醋酸根离子浓度小于③的二分之一
C.①③等体积混合以后,溶液呈酸性,则(Na+)>(CH3COO-)>(H+)
D.①②等体积混合以后,水的电离程度比①③等体积混合的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大量资金。请回答钢铁腐蚀与防护过程中的有关问题。
(1)钢铁的电化学腐蚀原理如图所示:

①写出石墨电极的电极反应式______;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在如图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向。______
③写出修改后石墨电极的电极反应式______。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式_____。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图:

①A电极对应的金属是__(写元素名称),B电极的电极反应式是____。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为___ mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序,但有严格准周期位置序的独特晶体。可通过___方法区分晶体、准晶体和非晶体。
(2)K元素的基态原子的电子填充于___个不同的能级。
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为___,写出一种与[H2F]+具有相同空间构型和键合形式的阴离子是___。
(4)NH4F(氟化铵)可作为玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是___;氟化铵中存在___(填字母)。
A.离子键 B.σ键 C.π键 D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似BornHaber循环能量构建能量图(见图a)计算相关键能。则F—F键的键能为___kJ·mol-1,S—F的键能为___kJ·mol-1。
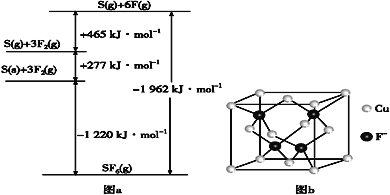
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
①CuF比CuCl熔点高的原因是___;
②已知NA为阿伏加德罗常数的值。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=___nm(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com