
【题目】下列说法中错误的是( )
A. 在煤中添加石灰石作脱硫剂
B. 将废弃塑料热裂解处理,可获得乙烯、丙烯等化工原料
C. 用催化法处理汽车尾气中的CO和NO:CO+NO![]() C+NO2
C+NO2
D. 利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图1实验装置进行制取氯酸钾和验证元素的非金属性相对强弱的实验。已知氯气在加热条件下与氢氧化钾反应生成氯酸钾、水和氯化钾。
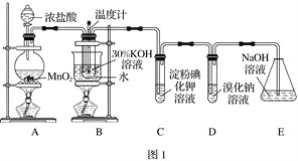
(1)A装置中反应的离子方程式为_______,B装置中反应的离子方程式为_______,B装置采用水浴加热的优点是_______。
(2)若对调B和C装置的位置,_____(填“能”或“不能”)提高B中氯酸钾的产率。
(3)验证非金属性:Cl>I的实验现象是_______,该装置______(填“能”或“不能”)验证非金属性:Cl>Br>I。
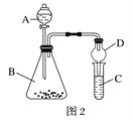
(4)利用如图2装置验证非金属性:C>Si,B中加Na2CO3,C中加Na2SiO3溶液,A中应该加入_____,C中反应的化学方程式:_____,D装置的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
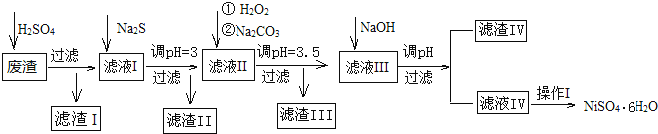
【题目】金属镍在电池和电镀等工业上具有广泛的用途,可镍也具有很强的毒性,若不进行回收处理,将对环境造成很大的影响,以下是以电镀废渣为原料获得NiSO46H2O的过程,已知,废渣中除含金属镍外,主要含有:Cu、Zn、Fe、Mg等元素的化合物。
部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见表.
沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
(1)往废渣中加H2SO4酸浸,提高酸浸效率的方法有__(至少写出2点)。
(2)加Na2S同时调溶液的pH为3,目的是除去铜、锌等杂质,则往滤液Ⅱ中加入H2O2的反应的离子方程式为___。
(3)操作Ⅰ包括以下过程:__、__、过滤、洗涤、干燥.该洗涤过程不能用水洗涤,应该用__洗涤,目的是___。干燥有低温干燥和高温干燥,能否用高温干燥___,理由是____。
(4)滤液Ⅲ中加入NaOH溶液的目的是调节溶液的pH为8以除去Al3+以及少量的Mg2+,若向含有Mg2+、Al3+的溶液中滴加NaOH溶液,常温下当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Al3+)=__。{已知:25℃时,Ksp[Mg(OH)2]=5.0×10-14;Ksp[Al(OH)3]=2.0×10-33}。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用失活的含镍催化剂(含NiB、MgO及SiO2等)为原料制备超细镍粉,其工艺流程如下:
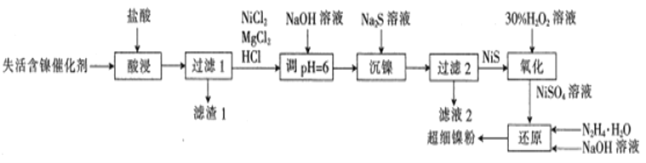
已知:pH=6时,Mg2+、Ni2+都不生成沉淀。
回答下列问题:
(1)非晶态NiB可由KBH4和Ni(NO3)2溶液反应制备。KBH4的电子式为_________
(2)“酸浸”时,为提高镍的浸取率可采取的措施是___________ (列举一点);滤值1中除了含有B单质外,还含有___________ (填化学式)。
(3)若流程中没有“NaOH溶液调pH=6”,则导致的后果是________
(4)“氧化”时发生反应的化学方程式为_______________;氧化时温度不宜超过50℃,其原因是_________________
(5)“还原”时产生无污染的气体,“还原”时发生反应的离子方程式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某氨基酸(CxHyNzOp)的分子组成。取m g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。按下图所示装置进行实验。

请回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是__________________
(2)以上装置中需要加热的仪器有_________________(用字母填空,下同)。操作时应先点燃_______处的酒精灯。
(3)A装置中发生反应的化学方程式是_____________________。
(4)装置D的作用是___________________________。
(5)读取N2的体积时,应注意
①______________________
②______________________
③______________________
(6)实验中测得N2的体积为V mL(标准状况)。为确定此氨基酸的化学式,还需要的有关数据是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO。
(1) Ca元素在周期表中位置是____,其原子结构示意图____。
(2) Ca与最活跃的非金属元素A形成化合物D,D的电子式为____,D的沸点比A与Si形成的化合物E的沸点____。
(3)配平用钙线氧脱鳞的化学方程式____:P+FeO+CaO![]() Ca3(PO4)2+Fe。
Ca3(PO4)2+Fe。
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为______;检测Mn+的方法是_____(用离子方程式表达)。
(5)取1.6 g钙线试样,与水充分反应,生成224 mL H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4xH2O)在电池工业、制药、照片显影等方面有重要作用。在实验室中用制备草酸亚铁并研究其性质,具体流程如图:
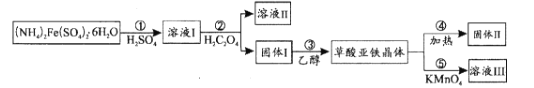
已知:常温下,pH>4时,Fe2+容易被氧化;H2C2O4的Ka1=5.9×10-2,Ka2=6.5×10-5;Ksp(FeC2O4xH2O)=3.2×10-7
回答下列问题:
(1)步骤①用水溶解的过程中,加入少量稀H2SO4的作用是_____。
(2)步骤②中加入的H2C2O4属于_____酸,生成固体I的离子反应方程式为_____。
(3)步骤③中先用水洗涤,再用乙醇洗涤,其目的是_____。
(4)步骤④是检验草酸亚铁晶体加热分解后的产物H2O、CO、CO2,首先检验的气体为_____,然后将剩余气体依次通过_____(填序号,装置可重复使用)→尾气处理。实验前需要将装置中的空气排尽,理由是_____。

(5)步骤⑤采用滴定分析法测定FeC2O4xH2O中x的值。取0.18g样品溶于稀硫酸配成100.00mL溶液,取20.00mL于锥形瓶中,用0.0100molL-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00mL。滴定终点的现象为_____,x值为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐 |
(1)已知NaNO2能发生如下反应:2NaNO2 + 4HI = 2NO↑+ I2+ 2NaI + 2H2O
请用双线桥表示电子转移的方向和数目____________。该反应中氧化产物是_____________(填化学式);若有2molHI被氧化,则被还原的氧化剂粒子数是________________。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化成Fe3+而中毒,可服用维生素C解毒。下列分析正确的是_____(填序号)
A. NaNO2被还原
B. 维生素C具有氧化性
C.还原性:Fe2+>维生素C
D. NaNO2是还原剂
(3)下列方法中,不能用来区分NaNO2和NaCl的是_________________(填序号)
A. 在酸性条件下加入KI淀粉溶液
B. 分别滴加酸化FeSO4溶液和KSCN溶液
C.焰色反应
D. 分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com