
ЁОЬтФПЁПФГаЫШЄаЁзщбаОПбЧЯѕЫсФЦ,ВщдФЯТСазЪСЯ,ЪдИљОнаХЯЂЛиД№ЯТСаЮЪЬт
вЉЦЗ | NaNO2ЃЈбЧЯѕЫсФЦЃЉ |
аджЪ | 1.дкЫсадШмвКжагаНЯЧПбѕЛЏадЃЌФмНЋFe2ЃЋбѕЛЏГЩFe3ЃЋЃЛ 2.AgNO2ЪЧвЛжжФбШмгкЫЎЁЂвзШмгкЫсЕФбЮ |
(1)вбжЊNaNO2ФмЗЂЩњШчЯТЗДгІЃК2NaNO2 + 4HI = 2NOЁќ+ I2+ 2NaI + 2H2O
ЧыгУЫЋЯпЧХБэЪОЕчзгзЊвЦЕФЗНЯђКЭЪ§ФП____________ЁЃИУЗДгІжабѕЛЏВњЮяЪЧ_____________ЃЈЬюЛЏбЇЪНЃЉЃЛШєга2molHIБЛбѕЛЏЃЌдђБЛЛЙдЕФбѕЛЏМССЃзгЪ§ЪЧ________________ЁЃ
(2)ЮѓЪГNaNO2ЛсЕМжТбЊКьЕААзжаЕФFe2ЃЋзЊЛЏГЩFe3ЃЋЖјжаЖОЃЌПЩЗўгУЮЌЩњЫиCНтЖОЁЃЯТСаЗжЮіе§ШЗЕФЪЧ_____ЃЈЬюађКХЃЉ
A. NaNO2БЛЛЙд
B. ЮЌЩњЫиCОпгабѕЛЏад
C.ЛЙдадЃКFe2ЃЋЃОЮЌЩњЫиC
D. NaNO2ЪЧЛЙдМС
(3)ЯТСаЗНЗЈжаЃЌВЛФмгУРДЧјЗжNaNO2КЭNaClЕФЪЧ_________________ЃЈЬюађКХЃЉ
A. дкЫсадЬѕМўЯТМгШыKIЕэЗлШмвК
B. ЗжБ№ЕЮМгЫсЛЏFeSO4ШмвККЭKSCNШмвК
C.бцЩЋЗДгІ
D. ЗжБ№ЕЮМгAgNO3ШмвК
(4)ФГЭЌбЇАбаТжЦЕФТШЫЎМгЕНNaNO2ШмвКжаЃЌЙлВьЕНТШЫЎЭЪЩЋЃЌЭЌЪБЩњГЩNaNO3КЭHClЃЌЧыаДГіЗДгІЕФРызгЗНГЬЪН_________________________________________________ЁЃ
ЁОД№АИЁП)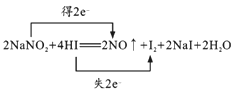 I2 2NA A CD NO2-+Cl2+H2O=NO3-+2H++2Cl-
I2 2NA A CD NO2-+Cl2+H2O=NO3-+2H++2Cl-
ЁОНтЮіЁП
ЃЈ1ЃЉ2NaNO2+4HIЃН2NOЁќ+I2+2NaI+2H2OжаЃЌNдЊЫиЕФЛЏКЯМлНЕЕЭЁЂIдЊЫиЕФЛЏКЯМлЩ§ИпЃЌИУЗДгІзЊвЦ2eЉЃЛ
ЃЈ2ЃЉNaNO2ЛсЕМжТбЊКьЕААзжаЕФFe2+зЊЛЏЮЊFe3+ЃЌNaNO2ОпгабѕЛЏадЃЌЗўгУЮЌЩњЫиC НтЖОЃЌПЩжЊЮЌЩњЫиCОпгаЛЙдадЃЛ
ЃЈ3ЃЉNaNO2КЭNaCl ЕФбєРызгЯрЭЌЁЂвѕРызгВЛЭЌЃЌНсКЯ2NaNO2+4HIЃН2NOЁќ+I2+2NaI+2H2OЁЂЬњРызггіKSCNШмвКЮЊбЊКьЩЋМјБ№ЃЛ
ЃЈ4ЃЉТШЫЎМгЕНNaNO2ШмвКжаЃЌЙлВьЕНТШЫЎЭЪЩЋЃЌЭЌЪБЩњГЩNaNO3КЭHClЃЌClдЊЫиЕФЛЏКЯМлНЕЕЭЁЂNдЊЫиЕФЛЏКЯМлЩ§ИпЁЃ
ЃЈ1ЃЉ2NaNO2+4HIЃН2NOЁќ+I2+2NaI+2H2OжаЃЌIдЊЫиЕФЛЏКЯМлЩ§ИпЃЌдђбѕЛЏВњЮяЮЊI2ЃЌгЩЗДгІПЩжЊ2molHIБЛбѕЛЏЃЌдђБЛбѕЛЏЕФСЃзгЪ§ЮЊ2NAЃЌNдЊЫиЕФЛЏКЯМлНЕЕЭЁЂIдЊЫиЕФЛЏКЯМлЩ§ИпЃЌИУЗДгІзЊвЦ2eЉЃЌгУЫЋЯпЧХБэЪОЕчзгзЊвЦЕФЗНЯђКЭЪ§ФПЮЊ ЃЌ
ЃЌ
ЙЪД№АИЮЊЃК ЃЛI2ЃЛ2NAЃЛ
ЃЛI2ЃЛ2NAЃЛ
ЃЈ2ЃЉAЁЂNдЊЫиЕФЛЏКЯМлНЕЕЭЃЌдђNaNO2БЛЛЙдЃЌЙЪAе§ШЗЃЛ
BЁЂЮЌЩњЫиCНтЖОЪБЃЌFeдЊЫиЕФЛЏКЯМлНЕЕЭЃЌдђЮЌЩњЫиCОпгаЛЙдадЃЌЙЪBДэЮѓЃЛ
CЁЂНсКЯбЁЯюBПЩжЊЛЙдадЃКЮЌЩњЫиCЃОFe2+ЃЌЙЪCДэЮѓЃЛ
DЁЂNaNO2ЪЧбѕЛЏМСЃЌЙЪDДэЮѓЃЛ
ЙЪД№АИЮЊЃКAЃЛ
ЃЈ3ЃЉAЁЂдкЫсадЬѕМўЯТМгШыKI ЕэЗлШмвКЃЌЩњГЩЦјЬхВЂЧвШмвКБфРЖЕФЮЊNaNO2ЃЌЮоЯжЯѓЕФЮЊNaClЃЌПЩМјБ№ЃЌЙЪAВЛЗћКЯЬтвтЃЛ
BЁЂЗжБ№ЕЮМгЫсЛЏFeSO4ШмвККЭKSCN ШмвКЃЌГіЯжбЊКьЩЋЕФЮЊNaNO2ЃЌЮоЯжЯѓЕФЮЊNaClЃЌПЩМјБ№ЃЌЙЪBВЛЗћКЯЬтвтЃЛ
CЁЂбцЩЋЗДгІОљЮЊЛЦЩЋЃЌВЛФмМјБ№ЃЌЙЪCЗћКЯЬтвтЃЛ
DЁЂЗжБ№ЕЮМгAgNO3ШмвКЃЌОљЩњГЩАзЩЋГСЕэЃЌВЛФмМјБ№ЃЌЙЪDЗћКЯЬтвтЃЛ
ЙЪД№АИЮЊЃКCDЃЛ
ЃЈ4ЃЉТШЫЎМгЕНNaNO2ШмвКжаЃЌЙлВьЕНТШЫЎЭЪЩЋЃЌЭЌЪБЩњГЩNaNO3КЭHClЃЌClдЊЫиЕФЛЏКЯМлНЕЕЭЁЂNдЊЫиЕФЛЏКЯМлЩ§ИпЃЌгЩЕчзгЁЂЕчКЩМАдзгЪиКуПЩжЊРызгЗДгІЮЊNO2Љ+Cl2+H2OЃНNO3Љ+2H++2ClЉЃЌЙЪД№АИЮЊЃКNO2Љ+Cl2+H2OЃНNO3Љ+2H++2ClЉЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈжаДэЮѓЕФЪЧ(ЁЁЁЁ)
A. дкУКжаЬэМгЪЏЛвЪЏзїЭбСђМС
B. НЋЗЯЦњЫмСЯШШСбНтДІРэЃЌПЩЛёЕУввЯЉЁЂБћЯЉЕШЛЏЙЄдСЯ
C. гУДпЛЏЗЈДІРэЦћГЕЮВЦјжаЕФCOКЭNOЃКCOЃЋNO![]() CЃЋNO2
CЃЋNO2
D. РћгУЖўбѕЛЏЬМЕШдСЯКЯГЩОлЬМЫсѕЅРрПЩНЕНтЫмСЯДњЬцОлввЯЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИжЬњЙЄвЕЪЧЙњМвЙЄвЕЕФЛљДЁЃЌИжЬњЩњатЯжЯѓШДЫцДІПЩМћЃЌЮЊДЫУПФъЙњМвЫ№ЪЇДѓСПзЪН№ЁЃЧыЛиД№ИжЬњИЏЪДгыЗРЛЄЙ§ГЬжаЕФгаЙиЮЪЬтЁЃ
ЃЈ1ЃЉИжЬњЕФЕчЛЏбЇИЏЪДдРэШчЭМЫљЪОЃК

ЂйаДГіЪЏФЋЕчМЋЕФЕчМЋЗДгІЪН______ЃЛ
ЂкНЋИУзАжУзїМђЕЅаоИФМДПЩГЩЮЊИжЬњЕчЛЏбЇЗРЛЄЕФзАжУЃЌЧыдкШчЭМащЯпПђФкЫљЪОЮЛжУзїГіаоИФЃЌВЂгУМ§ЭЗБъГіЕМЯпжаЕчзгСїЖЏЗНЯђЁЃ______
ЂлаДГіаоИФКѓЪЏФЋЕчМЋЕФЕчМЋЗДгІЪН______ЁЃ
ЃЈ2ЃЉЩњВњжаПЩгУбЮЫсРДГ§ЬњатЁЃЯжНЋвЛЩњатЕФЬњЦЌЗХШыбЮЫсжаЃЌЕБЬњатБЛГ§ОЁКѓЃЌШмвКжаЗЂЩњЕФЛЏКЯЗДгІЕФЛЏбЇЗНГЬЪН_____ЁЃ
(3)дкЪЕМЪЩњВњжаЃЌПЩдкЬњМўЕФБэУцЖЦЭЗРжЙЬњБЛИЏЪДЁЃзАжУЪОвтЭМШчЭМЃК

ЂйAЕчМЋЖдгІЕФН№ЪєЪЧ__(аДдЊЫиУћГЦ)ЃЌBЕчМЋЕФЕчМЋЗДгІЪНЪЧ____ЁЃ
ЂкШєЕчЖЦЧАЬњЁЂЭСНЦЌН№ЪєжЪСПЯрЭЌЃЌЕчЖЦЭъГЩКѓНЋЫќУЧШЁГіЯДОЛЁЂКцИЩЁЂГЦСПЃЌЖўепжЪСПВюЮЊ5.12gЃЌдђЕчЖЦЪБЕчТЗжаЭЈЙ§ЕФЕчзгЮЊ___ molЁЃ
ЂлЖЦВуЦЦЫ№КѓЃЌЖЦЭЬњБШЖЦаПЬњИќШнвзБЛИЏЪДЃЌЧыМђвЊЫЕУїдвђ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏКЯЮяЕФНсЙЙМђЪНШчЭМЫљЪО: ![]() (a)ЁЂ
(a)ЁЂ![]() (b)ЁЂ
(b)ЁЂ![]() (c)ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
(c)ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. Ш§жжЮяжЪжажЛгаaЁЂbЛЅЮЊЭЌЗжвьЙЙЬх
B. aЁЂbЁЂcЗжБ№га3жжЁЂ4жжЁЂ5жжВЛЭЌЛЏбЇЛЗОГЕФЧтдзг
C. aЁЂbЁЂcОљФмЗЂЩњбѕЛЏЗДгІЁЂШЁДњЗДгІЁЂМгГЩЗДгІ
D. cЗжзгФкжСЩйга6ИіЬМдзгЙВЦНУц
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиШмжЪЕФжЪСПЗжЪ§КЭЮяжЪЕФСПХЈЖШЕФМЦЫуНсЙћДэЮѓЕФЪЧ
A.УмЖШЮЊ0.91g/cm3ЕФАБЫЎЃЌжЪСПЗжЪ§ЮЊ25%ЃЌИУАБЫЎгУЕШЬхЛ§ЕФЫЎЯЁЪЭКѓЃЌЫљЕУШмвКжаШмжЪЕФжЪСПЗжЪ§ЕШгк12.5%
B.гаK2SO4КЭAl2(SO4)3ЕФЛьКЯШмвКЃЌвбжЊЦфжаAl3ЃЋЕФЮяжЪЕФСПХЈЖШЮЊ0.4 mol/L ЃЌSO42ЃЕФЮяжЪЕФСПХЈЖШЮЊ0.7 mol/L ЃЌдђДЫШмвКжаKЃЋЕФЮяжЪЕФСПХЈЖШЮЊ0.2 mol/L
C.НЋ5 mol/L ЕФMg(NO3)2ШмвКamL ЯЁЪЭжСbmLЃЌЯЁЪЭКѓШмвКжаNO3ЃЕФЮяжЪЕФСПХЈЖШЮЊ![]() mol/L
mol/L
D.НЋБъзМзДПіЯТЃЌНЋVL AЦјЬхЃЈФІЖћжЪСПЮЊMg/molЃЉШмгк0.1LЫЎжаЃЌЫљЕУШмвКУмЖШІбg/cm3ЃЌдђДЫШмвКЕФЮяжЪЕФСПХЈЖШЮЊ![]() mol/L
mol/L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮяжЪAЁЂBЁЂCЁЂDЁЂEЁЂFЁЂGЁЂHЁЂIЁЂJЁЂKДцдкЯТЭМзЊЛЏЙиЯЕЃЌЦфжаЦјЬхDЁЂEЮЊЕЅжЪЃЌЪдЛиД№ЃК
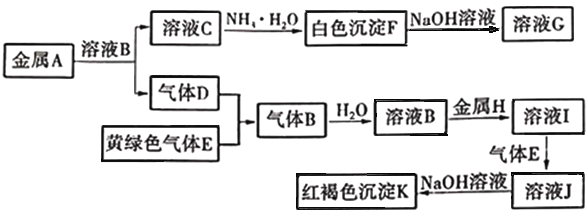
(1)аДГіЯТСаЮяжЪЕФЛЏбЇЪНЃКBЪЧ_________________ЃЌ FЪЧ_________________ЃЌKЪЧ_________________ЁЃ
(2)аДГіЗДгІ ЁАAЁњCЁБЕФРызгЗНГЬЪНЃК_________________________________________ЁЃ
(3)аДГіЗДгІ ЁАIЁњJЁБЕФЛЏбЇЗНГЬЪНЃК_________________________________________ЁЃ
(4)дкШмвКжаЕЮМгNaOHШмвКЃЌПЩЙлВьЕНЕФЯжЯѓЪЧ_____________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗњМАЦфЛЏКЯЮягУЭОЗЧГЃЙуЗКЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉОлЫФЗњввЯЉЪЧвЛжжзМОЇЬхЃЌИУОЇЬхЪЧвЛжжЮоЦНвЦжмЦкађЃЌЕЋгабЯИёзМжмЦкЮЛжУађЕФЖРЬиОЇЬхЁЃПЩЭЈЙ§___ЗНЗЈЧјЗжОЇЬхЁЂзМОЇЬхКЭЗЧОЇЬхЁЃ
ЃЈ2ЃЉKдЊЫиЕФЛљЬЌдзгЕФЕчзгЬюГфгк___ИіВЛЭЌЕФФмМЖЁЃ
ЃЈ3ЃЉ[H2F]+[SbF6]-(ЗњЫсЬр)ЪЧвЛжжГЌЧПЫсЃЌДцдк[H2F]+ЃЌИУРызгЕФПеМфЙЙаЭЮЊ___ЃЌаДГівЛжжгы[H2F]+ОпгаЯрЭЌПеМфЙЙаЭКЭМќКЯаЮЪНЕФвѕРызгЪЧ___ЁЃ
ЃЈ4ЃЉNH4F(ЗњЛЏяЇ)ПЩзїЮЊВЃСЇЪДПЬМСЁЂЗРИЏМСЁЂЯћЖОМСЕШЁЃNH4+ЕФжааФдзгЕФдгЛЏРраЭЪЧ___ЃЛЗњЛЏяЇжаДцдк___(ЬюзжФИ)ЁЃ
A.РызгМќ B.ІвМќ C.ІаМќ D.ЧтМќ
ЃЈ5ЃЉSbF6БЛЙуЗКгУзїИпбЙЕчЦјЩшБИОјдЕНщжЪЁЃSbF6ЪЧвЛжжЙВМлЛЏКЯЮяЃЌПЩЭЈЙ§РрЫЦBornHaberбЛЗФмСПЙЙНЈФмСПЭМ(МћЭМa)МЦЫуЯрЙиМќФмЁЃдђFЁЊFМќЕФМќФмЮЊ___kJЁЄmol-1ЃЌSЁЊFЕФМќФмЮЊ___kJЁЄmol-1ЁЃ
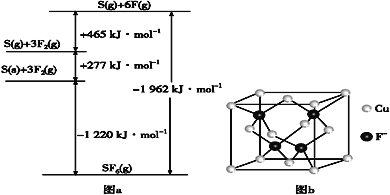
ЃЈ6ЃЉCuClЕФШлЕуЮЊ426ЁцЃЌШлЛЏЪБМИКѕВЛЕМЕчЃЛCuFЕФШлЕуЮЊ908ЁцЃЌУмЖШЮЊ7.1gЁЄcm-3ЁЃ
ЂйCuFБШCuClШлЕуИпЕФдвђЪЧ___ЃЛ
ЂквбжЊNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃCuFЕФОЇАћНсЙЙШчЁАЭМbЁБЁЃдђCuFЕФОЇАћВЮЪ§a=___nm(СаГіМЦЫуЪН)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщЮяжЪжаЃЌТњзуЭМжаЫљЪОЮяжЪзЊЛЏЙиЯЕЧвОЙ§вЛВНОЭФмЪЕЯжЕФЪЧ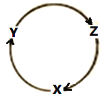
бЁЯю | X | Y | Z |
A | Na | NaOH | Na2O2 |
B | Fe | FeCl2 | Fe(OH)3 |
C | NO | NO2 | HNO3 |
D | Al | Al2O3 | Al(OH)3 |
A.AB.BC.CD.D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчБэЪЧдЊЫижмЦкБэЕФвЛВПЗжЃЌИљОнБэжаИјГіЕФ10жждЊЫиЃЌАДвЊЧѓзїД№ЁЃ
ЁЁЁЁзх жмЦкЁЁЁЁ | ЂёA | ЂђA | ЂѓA | ЂєA | ЂѕA | ЂіA | ЂїA | 0 |
2 | N | O | F | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
ЃЈ1ЃЉН№ЪєадзюЧПЕФдЊЫиЪЧ_______ЃЛ
ЃЈ2ЃЉFЕФдзгНсЙЙЪОвтЭМЪЧ________ЃЛ
ЃЈ3ЃЉЕиПЧжаКЌСПзюЖрЕФдЊЫиЪЧ_______ЃЛ
ЃЈ4ЃЉNeдзгЕФзюЭтВуЕчзгЪ§ЪЧ_______ЃЛ
ЃЈ5ЃЉNгыOдзгАыОЖНЯДѓЕФЪЧ_______ЃЛ
ЃЈ6ЃЉH2SгыHClШШЮШЖЈадНЯШѕЕФЪЧ______ЃЛ
ЃЈ7ЃЉNa2OгыMgOФбгыЫЎЗДгІЕФЪЧ______ЃЛ
ЃЈ8ЃЉMg(OH)2гыAl(OH)3ФмгыЧПМюЗДгІЕФЪЧ______ЃЛ
ЃЈ9ЃЉгУгкжЦдьЙтЕМЯЫЮЌЕФЮяжЪЪЧ______(ЬюЁАSiЁБЛђЁАSiO2ЁБ)ЃЛ
ЃЈ10ЃЉДЮТШЫс(HClO)ОпгаЩБОњЦЏАззїгУЃЌЦфжаClдЊЫиЕФЛЏКЯМлЮЊ____ЃЌHClOВЛЮШЖЈЃЌвзЗжНтЩњГЩHClКЭO2ЃЌаДГіЦфдкЙтееЬѕМўЯТЗжНтЕФЛЏбЇЗНГЬЪНЃК____ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com