
【题目】下列有关溶质的质量分数和物质的量浓度的计算结果错误的是
A.密度为0.91g/cm3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液中溶质的质量分数等于12.5%
B.有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol/L ,SO42-的物质的量浓度为0.7 mol/L ,则此溶液中K+的物质的量浓度为0.2 mol/L
C.将5 mol/L 的Mg(NO3)2溶液amL 稀释至bmL,稀释后溶液中NO3-的物质的量浓度为![]() mol/L
mol/L
D.将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度ρg/cm3,则此溶液的物质的量浓度为![]() mol/L
mol/L
【答案】A
【解析】
A、依据加水稀释前后溶质的质量不变,该氨水用等体积的水稀释后,所得氨水的质量为水的质量加上原有氨水的质量,所得氨水溶液的溶质为质量分数为25%的氨水中的溶质;
B、由于溶液中c(H+)和c(OH﹣)很小,可忽略不计,溶液呈电中性,根据电荷守恒:3c(Al3+)+c(K+)=2c(SO42﹣);
C、先计算出稀释前硝酸根离子的浓度,然后根据稀释过程中硝酸根离子的物质的量不变计算;
D、根据n=![]() 来计算气体的物质的量,根据m=nM计算气体的质量,根据m=ρV计算水的质量,溶剂和溶质的质量和为溶液的质量,利用V=
来计算气体的物质的量,根据m=nM计算气体的质量,根据m=ρV计算水的质量,溶剂和溶质的质量和为溶液的质量,利用V=![]() 来计算溶液的体积,最后利用c=
来计算溶液的体积,最后利用c=![]() 来计算该溶液的物质的量浓度。
来计算该溶液的物质的量浓度。
A、设加入水的体积为V,那么质量分数为25%的氨水的体积也为V,该氨水用等体积的水稀释后,所得溶液中溶质的质量分数为:![]() ×100%≈11.9%<12.5%,故A错误;
×100%≈11.9%<12.5%,故A错误;
B、由于溶液中c(H+)和c(OH﹣)很小,可忽略不计,溶液呈电中性,根据电荷守恒:3c(Al3+)+c(K+)=2c(SO42﹣),即3×0.4ol/L+c(K+)=2×0.7mol/L,c(K+)=2×0.7mol/L﹣3×0.4mol/L=0.2mol/L,故B正确;
C、5mol/L的Mg(NO3)2溶液中硝酸根离子的浓度为:5mol/L×2=10mol/L,将a mL该溶液稀释至b mL,稀释过程中硝酸根离子的物质的量不变,稀释后溶液中NO3﹣的物质的量浓度是:![]() =
=![]() mol/L,故C正确;
mol/L,故C正确;
D、气体的物质的量=![]() mol,故气体的质量=
mol,故气体的质量=![]() mol×Mg/mol=
mol×Mg/mol=![]() g,0.1L水的质量为100mL×1g/mL=100g,溶液的质量为(100+
g,0.1L水的质量为100mL×1g/mL=100g,溶液的质量为(100+![]() )g,溶液的体积为
)g,溶液的体积为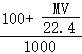 L,所以溶液的物质的量浓度=
L,所以溶液的物质的量浓度=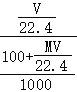 =
=![]() mol/L,故D正确。
mol/L,故D正确。
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出一种高性能水系酸碱双液锌一溴二次电池,其总反应为:Zn+2OH-+Br3-![]() ZnO+H2O+3Br-,中间的双极性膜(BPM)能隔开酸碱双液且能允许K+通过,如图所示。下列说法正确的是( )
ZnO+H2O+3Br-,中间的双极性膜(BPM)能隔开酸碱双液且能允许K+通过,如图所示。下列说法正确的是( )
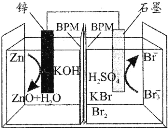
A.放电时,K+向石墨电极迁移
B.放电时,锌电极的电势高于石墨电极
C.充电时,阴极室的pH减小
D.充电时,石墨电极发生反应:Br3--2e-=3Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,15g甲基(-CH3)所含的电子数为10NA
B. 常温常压,11.2L氦气中含有的原子数为0.5NA
C. 标准状况下,4.48L重水(D2O)中含有的中子数为2NA
D. 常温常压下,23gNO2和N2O4的混合物中含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是( )
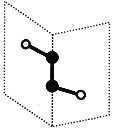
A.离子半径:W>Z>Y>X
B.ZY2和WY2都可以使品红溶液褪色但褪色原理不同
C.氧化物对应的水化物的酸性:W>Z
D.X2Y2,Z2W2均含有非极性共价键且各原子都满足8电子的稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐 |
(1)已知NaNO2能发生如下反应:2NaNO2 + 4HI = 2NO↑+ I2+ 2NaI + 2H2O
请用双线桥表示电子转移的方向和数目____________。该反应中氧化产物是_____________(填化学式);若有2molHI被氧化,则被还原的氧化剂粒子数是________________。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化成Fe3+而中毒,可服用维生素C解毒。下列分析正确的是_____(填序号)
A. NaNO2被还原
B. 维生素C具有氧化性
C.还原性:Fe2+>维生素C
D. NaNO2是还原剂
(3)下列方法中,不能用来区分NaNO2和NaCl的是_________________(填序号)
A. 在酸性条件下加入KI淀粉溶液
B. 分别滴加酸化FeSO4溶液和KSCN溶液
C.焰色反应
D. 分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物是造成大气污染的主要物质。研究氮的化合物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:
2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:
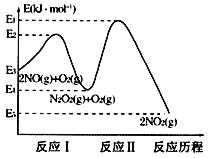
①写出反应I的热化学方程式___。
②对于总反应:2NO(g)+O2(g)![]() 2NO2(g),对该反应体系升高温度发现总反应速率反而变慢,其原因可能是__(反应未使用催化剂)。
2NO2(g),对该反应体系升高温度发现总反应速率反而变慢,其原因可能是__(反应未使用催化剂)。
(2)用焦炭还原NO2的反应为2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)___Kc(B)(填“<”“>”或“=”)
②A、B、C三点中NO2的转化率最低的是___(填“A”“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=___(Kp是用平衡分压代替平衡浓度计算)
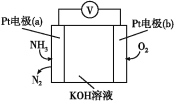
(3)电化学气敏传感器可以监测空气环境中NH3的含量,原理如图所示。负极的电极反应为___,假设有16.8L(标准状况)的氨气进入传感器参与反应,另一极需要通入标准状况下O2的体积为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用调味剂花椒油是一种从花椒籽中提取的挥发性香精油,可溶于乙醇、乙醚等有机溶剂。利用如图所示装置处理花椒籽粉,经分离提纯得到花椒油。
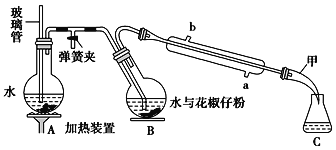
实验步骤:
(一)在A装置中的圆底烧瓶中装入![]() 容积的水,加几粒沸石。同时,在B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
容积的水,加几粒沸石。同时,在B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
(二)加热A装置中的圆底烧瓶,当有大量蒸气产生时关闭弹簧夹,进行蒸馏。
(三)向馏出液中加入食盐至饱和,再用15mL乙醚萃取2次,将两次萃取的醚层合并,加入少量无水Na2SO4;将液体倾倒入蒸馏烧瓶中,蒸馏得花椒油。
(1)装置A中玻璃管的作用是___,装置B中圆底烧瓶倾斜的目的是___。
(2)步骤(二)中,当观察到仪器甲中有无色油状液体馏出时,可停止蒸馏。蒸馏结束时,下列操作的顺序为___(填标号)。
①停止加热 ②打开弹簧夹 ③关闭冷凝水
(3)在馏出液中加入食盐的作用是___;加入无水Na2SO4的作用是___。
(4)实验结束后,用稀NaOH溶液清洗冷凝管,反应的化学方程式为___。
(残留物以 表示)
表示)
(5)为测定花椒油中油脂的含量,取20.00mL花椒油溶于乙醇中,加80.00mL0.5mol/LNaOH的乙醇溶液,搅拌,充分反应,加水配成200mL溶液。取25.00mL加入酚酞,用0.1moI/L盐酸进行滴定,滴定终点消耗盐酸20.00mL。则该花椒油中含有油脂___g/L。
(以 计,式量:884)。
计,式量:884)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为乙酸丁酯制备的实验装置,下列说法正确的是
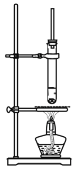
A.玻璃导管的主要作用是平衡试管内外压强
B.该装置适用于乙酸乙酯的制备
C.加入过量乙酸可以提高丁醇的转化率
D.分离提纯乙酸丁酯的方法是将混合物直接分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com