
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,15g甲基(-CH3)所含的电子数为10NA
B. 常温常压,11.2L氦气中含有的原子数为0.5NA
C. 标准状况下,4.48L重水(D2O)中含有的中子数为2NA
D. 常温常压下,23gNO2和N2O4的混合物中含有NA个氧原子
科目:高中化学 来源: 题型:
【题目】Ⅰ.某校化学实验兴趣小组为了验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),请按要求回答下列问题。
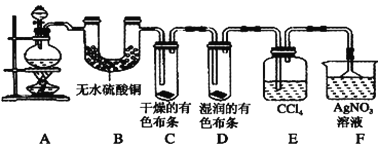
(1) 实验室制备Cl2所用的化学药品是________。
写出该反应的离子方程式,并用单线桥表示电子转移情况_____________________ ,此反应中每转移0.8mol电子,消耗Hcl____mol
(2)①装置B的作用是_______
②装置C和D出现的不同现象说明的问题是___
③装置E的作用是_______
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置___与___之间(填装置字母序号)增加一个装置,所增加装置里面的试剂可以为___(填字母序号)。
A.湿润的碘化钾淀粉试纸 B.浓硫酸 C.湿润的红色布条 D.饱和食盐水
Ⅱ.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为:_____________。
②漂白粉的有效成分是________________________。
③漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大量资金。请回答钢铁腐蚀与防护过程中的有关问题。
(1)钢铁的电化学腐蚀原理如图所示:

①写出石墨电极的电极反应式______;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在如图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向。______
③写出修改后石墨电极的电极反应式______。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式_____。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图:

①A电极对应的金属是__(写元素名称),B电极的电极反应式是____。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为___ mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2加氢可转化为高附加值的CO、CH4、CH3OH等C1产物。该过程可缓解CO2带来的环境压力,同时可变废为宝,带来巨大的经济效益。CO2加氢过程,主要发生的三个竞争反应为:
反应i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.01kJmol-1
CH3OH(g)+H2O(g)△H=-49.01kJmol-1
反应ii:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-165.0kJmol-1
CH4(g)+2H2O(g)△H=-165.0kJmol-1
反应iii:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.17kJmol-1
CO(g)+H2O(g)△H=+41.17kJmol-1
回答下列问题:
(1)由CO、H2合成甲醇的热化学方程式为_____。
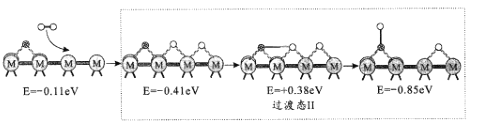
(2)反应iii为逆水煤气变换反应,简称RWGS。以金属催化剂为例,该反应历程的微观示意和相对能量(eV)变化图如图所示(![]() 为催化剂,
为催化剂,![]() 为C原子,
为C原子,![]() 为O原子,o为H原子)
为O原子,o为H原子)
历程I:

历程II:
历程III:
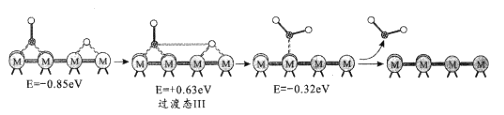
①历程1方框内反应的方程式为CO2*+*=CO*+O*(*为催化剂活性位点)。根据图示,其反应热△H_____0(填“>”或“<”)。
②反应历程II方框内的方程式是_____。
③反应历程中_____(填“历程I”、“历程II”或“历程III”)是RWGS的控速步骤。
(3)我国科学家研究了不同反应温度对含碳产组成的影响。在反应器中按 =3:1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):
=3:1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):

①1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_____、_____。M点CO平衡组成含量高于N点的原因是_____。
②当CH4和CO平衡组成为40%时,该温度下反应iii的平衡常数Kp为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物的结构简式如图所示: ![]() (a)、
(a)、![]() (b)、
(b)、![]() (c)。下列说法正确的是
(c)。下列说法正确的是
A. 三种物质中只有a、b互为同分异构体
B. a、b、c分别有3种、4种、5种不同化学环境的氢原子
C. a、b、c均能发生氧化反应、取代反应、加成反应
D. c分子内至少有6个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶质的质量分数和物质的量浓度的计算结果错误的是
A.密度为0.91g/cm3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液中溶质的质量分数等于12.5%
B.有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol/L ,SO42-的物质的量浓度为0.7 mol/L ,则此溶液中K+的物质的量浓度为0.2 mol/L
C.将5 mol/L 的Mg(NO3)2溶液amL 稀释至bmL,稀释后溶液中NO3-的物质的量浓度为![]() mol/L
mol/L
D.将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度ρg/cm3,则此溶液的物质的量浓度为![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序,但有严格准周期位置序的独特晶体。可通过___方法区分晶体、准晶体和非晶体。
(2)K元素的基态原子的电子填充于___个不同的能级。
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为___,写出一种与[H2F]+具有相同空间构型和键合形式的阴离子是___。
(4)NH4F(氟化铵)可作为玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是___;氟化铵中存在___(填字母)。
A.离子键 B.σ键 C.π键 D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似BornHaber循环能量构建能量图(见图a)计算相关键能。则F—F键的键能为___kJ·mol-1,S—F的键能为___kJ·mol-1。
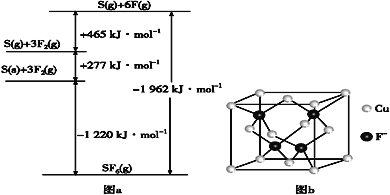
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
①CuF比CuCl熔点高的原因是___;
②已知NA为阿伏加德罗常数的值。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=___nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸及其盐溶液有杀菌、消毒、漂白的作用。在此次抗击新冠疫情中发挥了巨大作用。某学习小组根据需要欲制备浓度不小于0.8mol·L-1的次氯酸溶液。
(查阅资料)
资料1:常温常压下,Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水,且会与水反应生成次氯酸。
资料2:Cl2O的沸点为3.8℃,42℃以上会分解生成Cl2和O2;Cl2的沸点为-34.6℃
该小组用Cl2与潮湿的碳酸钠制取Cl2O,并进一步制取次氯酸,装置如下。
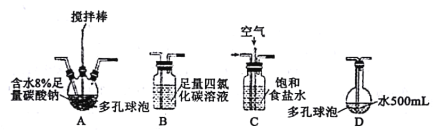
回答下列问题:
(1)装置连接顺序为Cl2→___。(用字母表示)
(2)装置A中反应的化学方程式是___。
(3)装置B的作用___,整个实验加快反应速率所采用的方法有___。
(4)装置D中反应的化学方程式是___。
(5)如果要收集Cl2O,则可以在B装置后连接E装置进行收集,这样做的依据是什么___,逸出气体的主要成分是___。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是___(答出一条即可)。
(7)测定反应完成后A中物质的质量分数:取mg样品加适量蒸馏水使之溶解,加入几滴酚酞,用0.1molL-1的盐酸标准溶液滴定至溶液由红色变为无色,消耗盐酸V1mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸V2mL。
①则由上述实验可测定反应完成后A中物质的质量分数为___(说明具体物质并用含m、V1和V2的代数式表示)。
②若用甲基橙作指示剂滴定结束时,滴定管尖嘴有气泡,对测定结果的影响是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com