
【题目】CO2加氢可转化为高附加值的CO、CH4、CH3OH等C1产物。该过程可缓解CO2带来的环境压力,同时可变废为宝,带来巨大的经济效益。CO2加氢过程,主要发生的三个竞争反应为:
反应i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.01kJmol-1
CH3OH(g)+H2O(g)△H=-49.01kJmol-1
反应ii:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-165.0kJmol-1
CH4(g)+2H2O(g)△H=-165.0kJmol-1
反应iii:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.17kJmol-1
CO(g)+H2O(g)△H=+41.17kJmol-1
回答下列问题:
(1)由CO、H2合成甲醇的热化学方程式为_____。
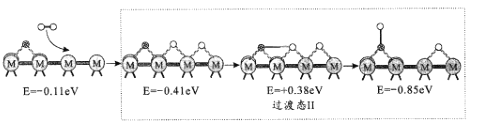
(2)反应iii为逆水煤气变换反应,简称RWGS。以金属催化剂为例,该反应历程的微观示意和相对能量(eV)变化图如图所示(![]() 为催化剂,
为催化剂,![]() 为C原子,
为C原子,![]() 为O原子,o为H原子)
为O原子,o为H原子)
历程I:

历程II:
历程III:
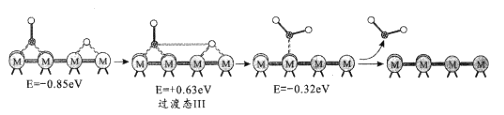
①历程1方框内反应的方程式为CO2*+*=CO*+O*(*为催化剂活性位点)。根据图示,其反应热△H_____0(填“>”或“<”)。
②反应历程II方框内的方程式是_____。
③反应历程中_____(填“历程I”、“历程II”或“历程III”)是RWGS的控速步骤。
(3)我国科学家研究了不同反应温度对含碳产组成的影响。在反应器中按 =3:1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):
=3:1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):

①1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_____、_____。M点CO平衡组成含量高于N点的原因是_____。
②当CH4和CO平衡组成为40%时,该温度下反应iii的平衡常数Kp为_____。
【答案】CO(g)+2H2(g)![]() CH3OH(g) △H=-90.18kJmol-1 < O*+H*=OH*+* 历程III a d 相同温度下,增大压强反应II向正方向移动,c(H2O)增大,使得反应III向逆方向移动,使得CO平衡组分降低 2.4
CH3OH(g) △H=-90.18kJmol-1 < O*+H*=OH*+* 历程III a d 相同温度下,增大压强反应II向正方向移动,c(H2O)增大,使得反应III向逆方向移动,使得CO平衡组分降低 2.4
【解析】
(1)反应i-反应iii即可得CO、H2合成甲醇的热化学方程式;
(2)①根据图示△H=-0.75eV+0.37eV=-0.38eV<0;
②根据图示书写方程式;
③根据图示比较每一个过程的相对能量变化值大小;
(3)①根据平衡移动进行分析比较;
②设起始时n(CO2)=5mol,则n(H2)=15mol,根据图象,当CH4和CO平衡组成为40%时,则CO2平衡组成为20%,所以△n(CO)=5mol×40%=2mol,△n(CH4)=5mol×40%=2mol,则:反应ii:![]() ,
,
反应iii:![]() ,
,
求出平衡时各物质的物质的量,带入平衡常数K=![]() 进行计算。
进行计算。
(1)反应i反应iii即可得CO、H2合成甲醇的热化学方程式:CO(g)+2H2(g) =C H3OH(g),计算焓变:△H=49kJmol141.17kJmol1=90.17kJmol1;
故答案为:CO(g)+2H2(g) =C H3OH(g)△H=90.17kJmol1;
(2)①根据图示△H=0.75eV+0.37eV=0.38eV<0,故答案为:<;
②根据图示,反应历程Ⅱ方框内的方程式是:O+H=OH,故答案为:O+H=OH;
③根据图示,历程Ⅲ的过渡态Ⅲ相对能量最大,即活化能最大,所以历程Ⅲ是RWGS的控速步骤,故答案为:历程Ⅲ;
(3)①对于反应ii,升高温度,平衡逆移,CH4、H2O的百分含量减少,对于平衡iii,升高温度,则平衡正移,CO的百分含量增加;增大压强,反应ii,平衡正移,H2O的百分含量增大,使反应Ⅲ逆移,CO百分含量降低,,综上:CH4、CO的变化幅度相对较小,则表示CH4和CO平衡组成随温度变化关系的曲线分别是a、d;
故答案为:a;d;相同温度下,增大压强反应II向正方向移动,c(H2O)增大,使得反应III向逆方向动,使得CO平衡组分降低;
②设起始时n(CO2)=5mol,则n(H2)=15mol,根据图象,当CH4和CO平衡组成为40%时,则CO2平衡组成为20%,所以△n(CO)=5mol×40%=2mol,△n(CH4)=5mol×40%=2mol,则
反应ii:![]() ,
,
反应iii:![]()
平衡时:n(CO2)=(522)mol=1mol,n(H2)=(1582)mol=5mol,n(CO)=2mol,n(H2O)=(4+2)mol=6mol,平衡常数![]() ;
;
故答案为:2.4。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】硫酸钠-过氧化氢加合物(xNa2SO4 ·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.77g样品,配制成100.00mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的氯化钡溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.0025mol。
③准确量取25.00mL溶液A,加入适量的稀硫酸酸化后,用0.02mol·L-1 KMnO4溶液滴定至终点(KMnO4只与加合物中的H2O2发生反应),消耗KMnO4溶液25.00mL。回答下列问题:
(1)在步骤①中,所需玻璃仪器除了烧杯外还需要________________;
(2)在步骤①中,下列操作会使所配溶液浓度偏低的是_______(填字母);
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视仪器上的刻度线
C.定容后震荡摇匀静置,发现液面低于刻度线,于是又加入少量水至刻度线
D.配制前容量瓶中有少量水
(3)③中的KMnO4溶液置于_______(“酸式”或“碱式”)滴定管中,滴定终点的现象是____________________,写出滴定中发生的离子反应方程式_______________;
(4)通过计算确定样品的组成为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是
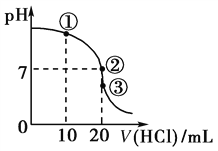
A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出一种高性能水系酸碱双液锌一溴二次电池,其总反应为:Zn+2OH-+Br3-![]() ZnO+H2O+3Br-,中间的双极性膜(BPM)能隔开酸碱双液且能允许K+通过,如图所示。下列说法正确的是( )
ZnO+H2O+3Br-,中间的双极性膜(BPM)能隔开酸碱双液且能允许K+通过,如图所示。下列说法正确的是( )
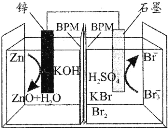
A.放电时,K+向石墨电极迁移
B.放电时,锌电极的电势高于石墨电极
C.充电时,阴极室的pH减小
D.充电时,石墨电极发生反应:Br3--2e-=3Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图装置进行CO和CO2混合气体的分离和干燥。其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否)。
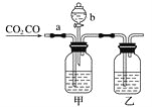
(1)从氢氧化钠、稀硫酸、浓硫酸几种物质中选择合适的物质填入下列空格中,便可达到实验目的,甲瓶内盛________溶液,乙瓶内盛________溶液,分液漏斗内盛________溶液。
(2)实验时先分离出CO,方法是先关闭___(填a或b,下同),打开___,写出此时发生反应的离子方程式:____。
(3)分离完CO后,再收集CO2,方法是先关闭____,再打开____,写出此时产生CO2反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,15g甲基(-CH3)所含的电子数为10NA
B. 常温常压,11.2L氦气中含有的原子数为0.5NA
C. 标准状况下,4.48L重水(D2O)中含有的中子数为2NA
D. 常温常压下,23gNO2和N2O4的混合物中含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是( )
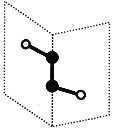
A.离子半径:W>Z>Y>X
B.ZY2和WY2都可以使品红溶液褪色但褪色原理不同
C.氧化物对应的水化物的酸性:W>Z
D.X2Y2,Z2W2均含有非极性共价键且各原子都满足8电子的稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物是造成大气污染的主要物质。研究氮的化合物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:
2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:
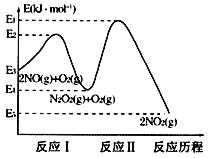
①写出反应I的热化学方程式___。
②对于总反应:2NO(g)+O2(g)![]() 2NO2(g),对该反应体系升高温度发现总反应速率反而变慢,其原因可能是__(反应未使用催化剂)。
2NO2(g),对该反应体系升高温度发现总反应速率反而变慢,其原因可能是__(反应未使用催化剂)。
(2)用焦炭还原NO2的反应为2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)___Kc(B)(填“<”“>”或“=”)
②A、B、C三点中NO2的转化率最低的是___(填“A”“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=___(Kp是用平衡分压代替平衡浓度计算)
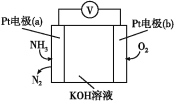
(3)电化学气敏传感器可以监测空气环境中NH3的含量,原理如图所示。负极的电极反应为___,假设有16.8L(标准状况)的氨气进入传感器参与反应,另一极需要通入标准状况下O2的体积为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年中国科学家合成了一种高能量密度材料,该成果发表在《Nature》上,合成该材料所需主要原料为草酰二肼(结构如图)。下列有关草酰二肼的说法不正确的是

A. 具有碱性
B. 完全水解可得3种化合物
C. 含有的官能团也存在于蛋白质分子中
D. 与联二脲( )互为同分异构体
)互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com