
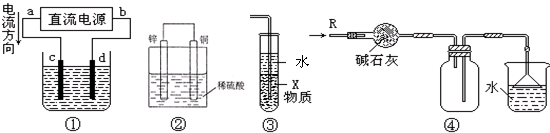
| A、若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| B、装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应 |
| C、装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c(NH4Cl)<c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2] |
| B、已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol?L-1 AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol?L-1 |
| C、0.2mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液的pH>1 |
| D、室温下,0.1mol?L-1 NaHA溶液的pH=4,则有C(HA-)>C(H+)>C(A2-)>C(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
A、
| ||||
| B、K2 | ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去AgI胶体中混有的I-离子--过滤、洗涤、干燥 |
| B、除去苯中含有的少量苯酚--加入NaOH溶液、分液 |
| C、分离CuSO4?5H2O和BaSO4的混合物--溶解、过滤 |
| D、除去乙酸乙酯中混有的乙酸杂质--加入NaOH溶液、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
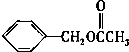 乙酸苯甲酯的结构简式如图,它有很多种同分异构体,其中含有酯基的一取代苯结构的同分异构体,除所给出的乙酸苯甲酯外,还有多少种( )
乙酸苯甲酯的结构简式如图,它有很多种同分异构体,其中含有酯基的一取代苯结构的同分异构体,除所给出的乙酸苯甲酯外,还有多少种( )| A、3 | B、4 | C、5 | D、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,28g N2和CO的混合气体体积为22.4L | ||
| B、任何物质的摩尔质量等于它的相对原子质量或相对分子质量 | ||
C、一个钠原子的质量约为
| ||
| D、CO2的摩尔质量为44g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com