
����Ŀ��һ���¶��£��������ݻ���ͬ�ĺ����ܱ������а���ͬ��ʽͶ�뷴Ӧ�������Ӧ 2SO2(g) + O2(g)![]() 2SO3(g)(����Ӧ����)�������������������˵����ȷ������ ��
2SO3(g)(����Ӧ����)�������������������˵����ȷ������ ��
���� 1 | ���� 2 | ���� 3 | |
��Ӧ�¶� T/K | 700 | 700 | 800 |
��Ӧ��Ͷ���� | 2molSO2�� 1molO2 | 4molSO3 | 2molSO2�� 1molO2 |
ƽ������(SO2 )/mol��L-1��s-1 | ��1 | ��2 | ��3 |
ƽ�� c(SO3 )/ mol��L-1 | c1 | c2 | c3 |
ƽ����ϵ��ѹǿ p/Pa | p1 | p2 | p3 |
���ʵ�ƽ��ת������ | ��1(SO2) | ��2(SO3) | ��3(SO2) |
ƽ�ⳣ�� K | K1 | K2 | K3 |
A. ��1<��2��c2<2c1 B. K1>K3��p2>2p3
C. ��1< ��3����1(SO2) > ��3(SO2) D. c2>2c3����2(SO3) +��3(SO2)<1
���𰸡�CD
��������
�Ա��������ص���������1������2�Աȣ�������1������3�Աȡ�����2�м���4molSO3��Ч������ͬ�����·�Ӧ��Ͷ����Ϊ4molSO2��2molO2������2����ʼ��Ӧ�����ʵ���Ϊ����1������������2�൱��������1�ﵽƽ�������ѹǿ���������������С��ԭ����һ�룬����ѹǿ��ѧ��Ӧ���ʼӿ죬![]() 2>
2>![]() 1������ѹǿƽ��������Ӧ�����ƶ���ƽ��ʱc2>2c1��p2<2p1����1(SO2) +��2(SO3)<1������1������2���¶���ͬ��K1= K2������3�൱��������1�ﵽƽ��������¶ȣ������¶Ȼ�ѧ��Ӧ���ʼӿ죬
1������ѹǿƽ��������Ӧ�����ƶ���ƽ��ʱc2>2c1��p2<2p1����1(SO2) +��2(SO3)<1������1������2���¶���ͬ��K1= K2������3�൱��������1�ﵽƽ��������¶ȣ������¶Ȼ�ѧ��Ӧ���ʼӿ죬![]() 3>
3>![]() 1�������¶�ƽ�����淴Ӧ�����ƶ���ƽ��ʱ��c3<c1��p3>p1�� ��3(SO2)< ��1(SO2)��K3< K1��
1�������¶�ƽ�����淴Ӧ�����ƶ���ƽ��ʱ��c3<c1��p3>p1�� ��3(SO2)< ��1(SO2)��K3< K1��
A���������������![]() 2>
2>![]() 1��c2>2c1����A������
1��c2>2c1����A������
B����K3< K1��p2<2p1��p3>p1����p2<2p3����B�����
C����![]() 3>
3>![]() 1����3(SO2)< ��1(SO2)����C��ȷ��
1����3(SO2)< ��1(SO2)����C��ȷ��
D����c2>2c1��c3<c1����c2>2c3����1(SO2) +��2(SO3)<1����3(SO2)< ��1(SO2)������2(SO3) +��3(SO2)<1����D��ȷ��
��ѡCD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Һ�����(��AG��ʾ)����Ϊc(H+)�� C(OH-)��ֵ�Ķ�������AG=lg![]() �������£����и���������AG��12����ɫ��Һ���ܴ���������ǣ�������
�������£����и���������AG��12����ɫ��Һ���ܴ���������ǣ�������
A. Mg2+��Ca2+��HCO3-��Cl-
B. K+��I-��SO42-��Br-
C. MnO4����Ca2+��Cl-��NO3��
D. Na+��Al(OH)4����Cl-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
�� H2(g)+![]() O2(g)��H2O(l) ��H ���D285kJ/mol
O2(g)��H2O(l) ��H ���D285kJ/mol
�� H2(g)+![]() O2(g)��H2O(g) ��H ���D241.8kJ/mol
O2(g)��H2O(g) ��H ���D241.8kJ/mol
�� C(s)+![]() O2(g)��CO(g) ��H ���D110.4 kJ/mol
O2(g)��CO(g) ��H ���D110.4 kJ/mol
�� C(s)+ O2(g)��CO2(g) ��H ���D393.5 kJ/mol
�ش����и��ʣ�
��1��������Ӧ�����ڷ��ȷ�Ӧ����___________��
��2��C��ȼ����Ϊ_________________��
��3��ȼ��10g H2����Һ̬ˮ���ų�������Ϊ_____________________��
��4��COȼ�յ��Ȼ�ѧ����ʽΪ______________________��
��5��Ϊ�˿�������ЧӦ��������ѧ������˲������롣���˸���Һ̬CO2�ܶȴ��ں�ˮ�ܶȵ���ʵ�����뽫CO2Һ������������ף��Լ��ٴ����е�CO2��ΪʹCO2Һ�����ɲ�ȡ�Ĵ�ʩ________��
a ��ѹ�����¡��������������� b ��ѹ������
c ��ѹ�����¡��������������� d ��ѹ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѿ�298K��101kPaʱ������˵������ȷ����
��Ӧ1��4Fe(s)+3O2(g) = 2Fe2O3 (s) ��H1 ����1648 kJ/mol
��Ӧ2��C(s) + O2 (g) = CO2 (g) ��H2 = ��393 kJ/mol
��Ӧ3��2Fe(s)+2C(s) +3O2(g) = 2FeCO3(s) ��H3 ����1480 kJ/mol
��Ӧ4��2FeCO3(s) +1/2O2(g) =2CO2(g) +Fe2O3(s) ��H4
A. ������Ӧ1.2.3.4������ѧ���Է����ƶ��ܴ�
B. ��Ӧ1��3�ڽϵ��¶������Է���Ӧ����Ӧ4��������Ӧ
C. �Է���Ӧ������Ӧһ���ܷ����������жϹ��̵ķ�������ȷ�����̷���������
D. ��Ӧ1��ʾ����������ȼ�յ��Ȼ�ѧ����ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2A(g)+3B(g)![]() 4C(g)+D(g)�� ��֪��ʼŨ��c(A)=4 mol��L-1��c(B)=3 mol��L-1��C��DŨ�Ⱦ�����0����Ӧ��ʼ2 ���ﵽƽ��״̬����ʱD ��ƽ��Ũ��Ϊ0.5 mol��L-1,������˵������ȷ����( )
4C(g)+D(g)�� ��֪��ʼŨ��c(A)=4 mol��L-1��c(B)=3 mol��L-1��C��DŨ�Ⱦ�����0����Ӧ��ʼ2 ���ﵽƽ��״̬����ʱD ��ƽ��Ũ��Ϊ0.5 mol��L-1,������˵������ȷ����( )
A. ��Ӧ����v(C)= 1mol/��L��s�� B. C��ƽ��Ũ��Ϊ4mol /L
C. A��ת����Ϊ25% D. B��ƽ��Ũ��Ϊ1.5mol /L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A.ͬ��Ԫ�ص��������ض���ͬ
B.��ͬԪ��ԭ�ӵ��������ض���ͬ
C.ԭ�Ӻ˶��������Ӻ����ӹ��ɵ�
D.���Ǻ����������ͬ�����ض�����ͬһԪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ������Ԫ�أ�������Ԫ�����ڱ������λ����ͼ��ʾ��Zԭ�ӵ������������ǵ�һ���������3��������˵������ȷ����
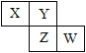
A. ԭ�Ӱ뾶��Z > Y > XB. �⻯���ȶ��ԣ�X > Y
C. �⻯��е㣺Z > YD. ����������Ӧ��ˮ�������ԣ�W > Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ�������ں���ɻ����乤��ԭ����ͼ��ʾ�����ڸ�ȼ�ϵ�ص�˵������ȷ����
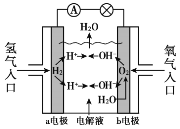
A. H2�ڸ�������������Ӧ
B. ���Ӵ�a�缫�����·����b�缫
C. ����ʱ���ܷ�ӦΪ��2H2 + O2 == 2H2O
D. ȼ�ϵ�ص�����ת���ʿɴ�100%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йس�����(������Ϊ����)���Լ��������У�����ȷ����
A.����(��ϩ)����ˮ��ϴ��B.�Ҵ�(ˮ)������
C.��������(����)������̼������Һ����ҺD.�屽(��)������������Һ����Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com