
某同学为研究电化学原理,使用KC1盐桥设计如图所示实验装置。下列分析不合理的是

A.闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动
B.无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是
C.闭合K,断开K2,电流从石墨电极经过K.流向铁电极
D.闭合K,断开K2,左侧烧杯中的溶液pH将逐渐降低
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2014-2015学年四川省遂宁市高三第二次诊断考试化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列叙述正确的是
A.标况下,2.8 L丙烷中含有的极性共价键数为NA
B.在反应KIO3 + 6HI = KI + 3I2 + 3H2O 中,每生成3 mol I2转移的电子数为6 NA
C.已知CH3COONH4溶液的PH=7,则1L 0.1mol/L的CH3COONH4溶液中,CH3COO- 数为0.1NA
D.39g Na2O2和Al(OH)3的混合物中阴、阳离子的总数为2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分散系中分散质粒子的大小:Fe (OH)3悬浊液<Fe (OH)3胶体<FeCl3溶液
B.可利用反应2CO=2C+O2(此反应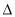 H>O、
H>O、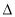 S<0)来消除CO污染
S<0)来消除CO污染
C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB
D.除去Cu粉中混有的CuO,可加入稀硝酸中,充分反应后过滤、洗涤、干燥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月月考理综化学试卷(解析版) 题型:选择题
一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。以下说法不正确的是

A.中间室Cl—移向左室
B.X气体为CO2
C.处理后的含硝酸根废水pH降低
D.电路中每通过1 mol电子,产生标准状况下氮气的体积为2.24L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三3月月考理综化学试卷(解析版) 题型:填空题
[化学一物质结构与性质)(13分)
I.镁条在空气中燃烧主要发生以下三个反应:
2Mg+O2 2MgO 3Mg+N2
2MgO 3Mg+N2 2Mg3N2 2Mg+CO2
2Mg3N2 2Mg+CO2 2MgO+C
2MgO+C
(1)基态氮原子核外电子的轨道表示式为 .
(2)上述三个反应中所涉及的非金属元素.的第一电离能由大到小的顺序为 。
(3)MgO的晶体结构模型如图所示,若MgO晶体密度为ρg/cm3,图示中O2-与O2-的核间距a= .

Ⅱ.Mg3N2溶于水发生反应:Mg3N2+8H2O=3Mg(OH)2↓+2NH3·H2O
(4)氨水中各种微粒间不涉及的作用力是 (填选项序号)。
A.离子键
B.共价键
C.配位键
D.金属键
E.氢键
F.范德华力
(5)在一定条件下将NH气与CO2混合可制得尿素[CO(NH2)2],尿素分子中 键的数目为 。
键的数目为 。
(6)向硫酸铜溶液中逐渐通入过量氨气,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。关于该晶体下列说法中正确的是 。
A.加入乙醇的目的是降低溶剂的极性,促使[Cn(NH3)4]SO4晶体析出
B.该配合物晶体中,N是配位原子,NH3为三角锥型,配位数是4
C.配离子内N原子排列成为平面正方形,可见Cu2+是sp3杂化
D.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三3月月考理综化学试卷(解析版) 题型:选择题
从化学看生活,你认为合理的说法是
A.塑料制品长期不使用也会老化
B.碱性食品是健康食品
C.燃烧产生烧蕉羽毛味的布料是纯羊毛制品
D.烧酒中最多的分子是乙醇分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:选择题
实验:①0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液等体积混合得到浊液,过滤。
②分别取少量①的滤液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清。
③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解。
下列分析不正确的是
A.实验②证明了①的滤液中含有Ag+,由此推断①的滤液中也含有Cl
B.实验②证明了该温度下Ag2S比Ag2SO4更难溶解
C.实验③的溶液中含有Ag(NH3)2+微粒
D.由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省商丘市高三第一次模拟考试化学试卷(解析版) 题型:填空题
(10分)(1)常温下,向20 mL 0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:

①当V(NaOH)=20mL时,溶液中离子浓度的大小关系: ___________________;
②等体积、等物质的量浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水_________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入___________。
(2)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是__________(填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:如果将反应温度提高到T2,Ru催化分解初始浓度为c0的氨气过程中α(NH3)—t的总趋势曲线(标注Ru—T2)

③假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K=_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:填空题
选做(12分)【化学-有机化学基础】
下列为合成聚合物F的路线图:


请根据以上信息,回答下列问题:
(1)A中含有官能团(不考虑苯环,下同)名称是_________,C的系统命名为_________。
(2)B+D→E的反应类型是__________,检验B中所含官能团所用的试剂有_______。
(3)C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为_______________。
(4)G物质的相对分子质量比 的相对分子质量大2,则符合下列条件的G的同分异构体有____种。
的相对分子质量大2,则符合下列条件的G的同分异构体有____种。
①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com