
【题目】CuCl2广泛应用于工业生产,溶于水形成绿色溶液。CuCl晶体呈白色,露置于潮湿空气中易被氧化,实验室用图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。
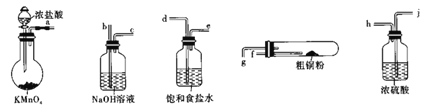
(1)完成上述实验,气流方向连接各仪器接口的顺序是________a→______、____→______、_____→______、 _________→________;反应时,盛粗铜粉的试管中现象是_______________。
(2)实验完毕,取试管中的固体有盐酸溶解后,欲提纯氯化铜,请简述实验方案:_________________。(室温,Fe(OH))3 沉淀完全的pH为3.2)
(3)向制得的氯化铜溶液中通入SO2,加热一段时间既可制得CuCl,写出该反应的离子方式:_______。
(4)已知:ⅰ.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O
ⅱ.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
某同学利用如图所示装置,测定某混合气体中H2、CO、SO2和O2的百分组成
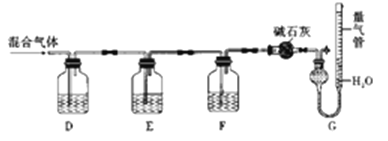
①D瓶测定__________;F洗气瓶中盛放的试剂是__________________。
②E瓶中发生反应的离子方程式为____________________。
③为了准确读取G中量气管的数据,读数时除了视线与凹液面最低处相平以外,还要注意__________。
【答案】d e j h f g b产生大量棕黄色的烟取盐酸溶解所得溶液,加入过量CuO或CuCO3、Cu(OH)2、Cu2(OH)2CO3调节溶液pH≥3.2,过滤取滤液2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++
2CuCl↓+4H++![]() SO2CuCl的盐酸溶液
SO2CuCl的盐酸溶液![]() + 3O2 + 4OH-=
+ 3O2 + 4OH-=![]() + 2H2O将实验装置恢复到室温,上下调节量气管,使左、右管中液面高度平齐
+ 2H2O将实验装置恢复到室温,上下调节量气管,使左、右管中液面高度平齐
【解析】
(1)制备纯净、干燥的氯气应选用饱和食盐水先除去挥发产生的氯化氢,再通过浓硫酸干燥与粗铜粉反应,最后用氢氧化钠溶液进行尾气处理,气体通过试剂瓶应长管进短管出,故顺序为d_ejhfgb;
(2)CuCl2溶液中混有FeCl3,加入CuO或CuCO3、Cu(OH)2、Cu2(OH)2CO3既能消耗H+调节溶液pH促使Fe3+沉淀,又不引入其他杂质,充分反应后过滤即可。
(3)氯化铜溶液中通入SO2,在加热条件下生成CuCl沉淀和H2SO4,发生反应的离子方式为_2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++
2CuCl↓+4H++![]() ;
;
(4)①氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故D中盛放氢氧化钡溶液吸收二氧化碳,E中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,F中盛放CuCl的盐酸溶液吸收CO,G测定氮气的体积;
②②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水,反应离子方程式为:2S2O42-+3O2+4OH-=4SO42-+2H2O;
③气体体积受温度和压强的影响,反应条件是常温、常压,故需恢复到室温并调节液面高度使量气管内压强为常压。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6 gX与Y完全反应后,生成4.4 gR,则 在此反应中,Y与R的化学式量之比为:
A.32: 18 B.16:11 C.8:11 D.16:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢(H2S)分子中两个共价键的夹角接近90°,其原因是( )
①共价键的饱和性②S原子的电子排布③共价键的方向性④S原子中p轨道的形状
A. ①② B. ①③ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.化学反应不一定都有能量变化
B.增大反应物浓度,活化分子百分数增大,化学反应速率一定增大
C.升高温度,活化分子百分数增大,化学反应速率一定增大
D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,雾霾又上了度娘热搜榜。其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质。
①写出该反应的化学反应方程式:_____________。
②已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.28kJ mol-1;
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2= -1269.02kJ mol-1。105℃时,则上述脱硝反应的△H=_______,该反应________(填“能” “否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为________。每生成1mol还原产物,则反应中转移电子数为_________mol。
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | lmolO3 2mol NO2 | lmolO3 2mol NO2 |
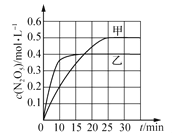
0~10min内甲容器中反应的平均速率:v(O3) =_______mol·L-1·min-1 。
②T1________T2 (填“>”“<”或“=”),T1时,该反应的平衡常数为____________。
③下列措施能提高容器乙中NO2转化率的是________(填序号)。
A.向容器中充入He,增大容器的压强
B.升高容器的温度
C.向容器中再充人一定量的NO2
D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1 NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,v(正)________v(逆) (填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电影《闪闪的红星》中,为让被困的红军战士吃上食盐,潘冬子将浸透食盐水的棉袄裹在身上,带进山中。假如潘冬子在实验室中,欲从食盐水中提取出食盐,采用的最好方法是:
A.过滤 B.萃取 C.蒸发 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。①A元素最外层电子数是次外层电子数的2倍。 ②B的阴离子和C的阳离子与氖原子的电子层结构相同。③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。请写出:
(1)A元素的最高价氧化物的结构式 。
(2)B元素在周期表中的位置 。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有 。
(4)D元素的低价氧化物与E的单质的水溶液反应的离子方程式为______________。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程的 。
(6)元素D与元素E相比,非金属性较强的是 (用元素符号表示),下列表述中能证 明这一事实的是 (填选项序号)。
a.常温下D的单质和E的单质状态不同 b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应 d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com