
【题目】下列物质中,既含有极性键又含有离子键的是
A. Na2O2 B. NH4Cl C. CaH2 D. NaCl
科目:高中化学 来源: 题型:
【题目】现有如下两个装置,其中锌片和铜片均为足量,请回答相关问题。

(1)装置乙中可观察到的现象是_______。
(2)若甲中所用硫酸为80%的浓硫酸,开始阶段可观察到的现象是_____,锌电极上发生的反应类型是_____(填“氧化反应”或“还原反应”),此时的总反映化学方程式为_______。一段时间后装置中发生了另一个反应,原因是_______,与开始阶段相比锌片上的反应是否发生了变化______(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应X(g)+Y(s)=2Z(g) ,下列条件不能改变化学反应速率的是
A. 升高温度 B. 加入催化剂 C. 再加入一定量的Y D. 扩大容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用2mL1molL-1 CuSO4 溶液和4mL0.5 molL-1 NaOH溶液混合,然后加入40%的甲醛溶液0.5mL,加热到沸腾,未见红色沉淀产生,主要原因是( )
A. 甲醛的量太少 B. CuSO4 的量太少 C. NaOH的量太少 D. 加热时间太短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁铝合金投入100 mL一定浓度的盐酸中,合金溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成的沉淀质量与加入的NaOH溶液的体积如图所示,由图中数据分析计算,正确的是( )

A. 原合金中镁的质量为9.6g
B. 铝的质量为5.4g
C. 盐酸的物质的量浓度为8mol/L
D. 图像中A点沉淀为Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子aA2+、bB+、cC3﹣、dD﹣都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径 A>B>D>C B. 原子序数 d>c>b>a
C. 离子半径 C>D>B>A D. 单质的还原性 A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+3B(g)![]() 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A.v(A)=0.01 mol/(Ls) B.v(C)=1.0mol/(Lmin)
C.v(B)=0.60mol/(Lmin) D.v(B)=0.04 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
物质 | A | B | C |
初始浓度/mol·L-1 | 1.0 | 2.0 | 0 |
2min时,平衡浓度/mol·L-1 | 0.4 | 0.2 | 1.2 |
请填写下列空白:
(1)该反应方程式可表示为: ;反应达平衡时,A的转化率为___________。
(2)从反应开始到达化学平衡,生成C的平均反应速率为 ;25℃时,反应的化学平衡常数K值(数值)为_____________。
(3)能判断该反应已达到化学平衡状态的依据是__________。
a.容器内压强不变
b.混合气体的密度不变
c.3v正(B)=2v逆(C)
d.c(A)=c(C)
e.混合气体的平均相对分子质量不变
(4)若已知该反应为放热反应,下图表示由于条件改变而引起反应速度和化学平衡的变化情况:
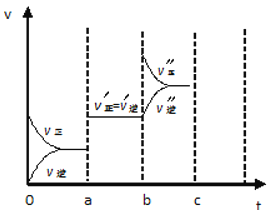
a 点时改变的条件可能是 ;b点时改变的条件可能是 。
(5)如果上述反应起始是按“1 mol A+3 mol B”充入,达平衡时C的浓度为a mol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为a mol/L的是 (填序号)
①2 mol A+6 mol B ②2mol C ③4mol C ④0.5 mol A+1.5mol B+1 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl2广泛应用于工业生产,溶于水形成绿色溶液。CuCl晶体呈白色,露置于潮湿空气中易被氧化,实验室用图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。
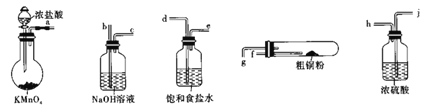
(1)完成上述实验,气流方向连接各仪器接口的顺序是________a→______、____→______、_____→______、 _________→________;反应时,盛粗铜粉的试管中现象是_______________。
(2)实验完毕,取试管中的固体有盐酸溶解后,欲提纯氯化铜,请简述实验方案:_________________。(室温,Fe(OH))3 沉淀完全的pH为3.2)
(3)向制得的氯化铜溶液中通入SO2,加热一段时间既可制得CuCl,写出该反应的离子方式:_______。
(4)已知:ⅰ.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O
ⅱ.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
某同学利用如图所示装置,测定某混合气体中H2、CO、SO2和O2的百分组成
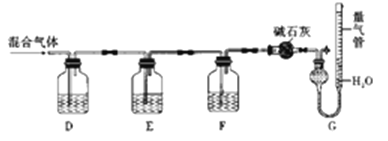
①D瓶测定__________;F洗气瓶中盛放的试剂是__________________。
②E瓶中发生反应的离子方程式为____________________。
③为了准确读取G中量气管的数据,读数时除了视线与凹液面最低处相平以外,还要注意__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com