
【题目】某学生用2mL1molL-1 CuSO4 溶液和4mL0.5 molL-1 NaOH溶液混合,然后加入40%的甲醛溶液0.5mL,加热到沸腾,未见红色沉淀产生,主要原因是( )
A. 甲醛的量太少 B. CuSO4 的量太少 C. NaOH的量太少 D. 加热时间太短
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(B类题)将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位。炼铁高炉中发生的关键反应如下:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
CO2(g)+C(s)=2CO(g) ΔH=+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+![]() O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
根据上面三个热化学方程式,回答下列问题:
(1)CO的燃烧热为____________;写出其热化学方程式 。
(2)高炉内Fe2O3被CO还原为Fe的热化学方程式为 。
(3)炼制1 t(吨)含铁96%的生铁所需焦炭的理论用量是________t(结果保留两位有效数字),实际生产中所需焦炭远高于理论用量,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用碱式滴定管量取25 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
回答下列问题:
(1)正确的操作步骤顺序中B前面是________、D后面是________(用字母填写)。
(2)滴定读数应注意:滴定管与水平的实验台面______________,并使刻度线与滴定管液面的____________相切。
(3)操作D中液面应调整到________________的某一刻度。
(4)滴定到终点时锥形瓶内溶液的pH约为_______________;终点时的颜色变化是________________。
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响_______________
(6)该烧碱样品的纯度计算式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
⑴写出基态Zn原子的价电子排布式__________,基态S原子核外未成对电子数为_____。
⑵ZnSO4中三种元素的电负性由大到小的顺序为_____________________,SO42-的立体构型为________________,其中S的杂化轨道类型为_________。
⑶硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有___________。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
⑷根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为___________;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因________________。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
⑸立方ZnS晶体的密度为ρg·cm-3,其晶胞结构如图。S2-周围等距离且最近的Zn2+、S2-依次为______、______;ZnS晶胞中的晶胞参数a=________nm(列出计算式)。
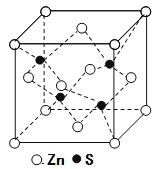
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢(H2S)分子中两个共价键的夹角接近90°,其原因是( )
①共价键的饱和性②S原子的电子排布③共价键的方向性④S原子中p轨道的形状
A. ①② B. ①③ C. ②③ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com