
【题目】下列物质在一定条件下既能发生银镜反应又能发生水解反应的是( )
A. 淀粉 B. 蔗糖 C. 葡萄糖 D. 麦芽糖
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 二氧化氯可用于自来水的杀菌消毒
B. 铝制餐具不宜用来蒸煮或长时间存放咸的食物
C. 把固体炸药制成胶体能提高威力
D. 做焰色反应时透过蓝色钴玻璃观察到紫色的现象说明待测液中一定含有钾盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应为___________反应。(填“吸热”或“放热”)
(2)830℃,c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L, C(H2)=0.05mol/L,该反应__________(填“是”或“否”)达到的化学平衡状态。
(3)800℃时,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01 mol/L,c(H2O)=0.03 mol/L,c(CO2)=0.01 mol/L,c(H2)=0.05 mol/L,则反应开始时,H2O的消耗速率比生成速率___________(填“大”、“小”或“不能确定”)
(4)830℃时,在1L的固定容积的密闭容器中放入2mol CO2和1mol H2,平衡后CO2的转化率为___________,H2的转化率为___________(用分数表示)。若再充入1mol H2则H2的转化率为___________(增大,减少,不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应X(g)+Y(s)=2Z(g) ,下列条件不能改变化学反应速率的是
A. 升高温度 B. 加入催化剂 C. 再加入一定量的Y D. 扩大容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,还含有CCl4、I2、I-等)中回收碘和CCl4,其实验过程如下:
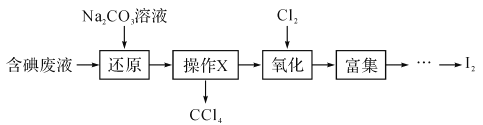
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为
______________;该操作将I2还原为I-的主要目的是 ____________ 。
(2)操作X的名称为 ___。
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是_____________;锥形瓶里盛放的溶液为_______________

(4)在教材碘水的萃取实验中,最后要从碘的CCl4溶液中回收利用CCl4,可以采用下列方法:先水浴加热蒸馏碘的CCl4溶液,收集得到浅红色的液体。再向该液体中加入少量块状的活性炭,静置。待溶液的浅红色消失。操作Y,即可得无色透明的CCl4液体。
①收集得到浅红色的液体说明,收集得到的液体中含有 ___(化学式),②加入少量活性炭的目的是 ______ ,③操作Y的名称是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用2mL1molL-1 CuSO4 溶液和4mL0.5 molL-1 NaOH溶液混合,然后加入40%的甲醛溶液0.5mL,加热到沸腾,未见红色沉淀产生,主要原因是( )
A. 甲醛的量太少 B. CuSO4 的量太少 C. NaOH的量太少 D. 加热时间太短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁铝合金投入100 mL一定浓度的盐酸中,合金溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成的沉淀质量与加入的NaOH溶液的体积如图所示,由图中数据分析计算,正确的是( )

A. 原合金中镁的质量为9.6g
B. 铝的质量为5.4g
C. 盐酸的物质的量浓度为8mol/L
D. 图像中A点沉淀为Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+3B(g)![]() 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A.v(A)=0.01 mol/(Ls) B.v(C)=1.0mol/(Lmin)
C.v(B)=0.60mol/(Lmin) D.v(B)=0.04 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展以煤制乙烯、丙烯、丁烯等低碳烯烃,部分替代石油化工产品的道路是我国保障能源安全战略的重要措施。间接法是先由煤制合成气(组成为H2、CO和少最的CO2)制备甲醇或二甲醚(CH3OCH3),其主要过程包括以下四个反应:
甲醇合成反应:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1 kJmol-1
CH3OH(g) △H1=-90.1 kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g) △H2=-49.0kJmol-1
CH3OH(g) +H2O(g) △H2=-49.0kJmol-1
水煤气变换反应:
③CO(g)+ H2O(g)![]() CO2(g)+ H2(g) △H3=-41.1kJmol-1
CO2(g)+ H2(g) △H3=-41.1kJmol-1
二甲醚合成反应:
④2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H4=-24.5kJmol-1
CH3OCH3(g)+H2O(g) △H4=-24.5kJmol-1
回答下列问题:
(1)分析上述反应(均可逆),发生反应④对于CO转化率的影响是_______(填“增大”、“减小”或“无影响”,其理由是__________。
(2)在二个体积均为1.0L的恒容密闭容器中发生上述二甲醚合成反应④。实验数据见下表:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
b | 387 | 0.40 | 0 | 0 | ||
c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
①387℃时,反应④的化学平衡常数K=__________。
②达到平衡时,容器b中CH3OH的转化率为________。
③达到平衡时,容器c中CH3OCH3的体积分数为________。
(3)由H2和CO可直接制备二甲醚:2CO2(g)+4H2(g)=CH3OCH(g)+H2O(g) ΔH=__________;为提高反应物的转化率,根据化学反应原理,理论上应采取的措施是________(填序号)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(4)有研究者用Cu-Zn-Al和Al2O3作催化剂,压强为5.0 MPa的条件下,由合成气[![]() =2]直接制备二甲醚,结果如下图所示.已知:选择性=
=2]直接制备二甲醚,结果如下图所示.已知:选择性=![]() ×100%。则有图可知二甲醚的选择性达最大值时对应的温度是____________。
×100%。则有图可知二甲醚的选择性达最大值时对应的温度是____________。

(5)2016年,我国的两个科研团队在合成气直接制备低碳烯烃(nCO+2nH2![]() CnH2n+nH2O)的研究中连续取得重大突破,论文分别发表在《德国应用化学》(2016.03.16)、《Nature》(2016.10.06)杂志上。
CnH2n+nH2O)的研究中连续取得重大突破,论文分别发表在《德国应用化学》(2016.03.16)、《Nature》(2016.10.06)杂志上。![]() =2时,前者在400℃,1MPa的条件下,CO转化率为11%,低碳烯烃选择性达74%;后者在250℃,0.1~0.5MPa的条件下,CO转化率为31.8%,低碳烯烃选择性为60.8%,则其中低碳烯烃的产率较大者的值为_________。
=2时,前者在400℃,1MPa的条件下,CO转化率为11%,低碳烯烃选择性达74%;后者在250℃,0.1~0.5MPa的条件下,CO转化率为31.8%,低碳烯烃选择性为60.8%,则其中低碳烯烃的产率较大者的值为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com