
【题目】下列说法中正确的是( )
A.SO2的水溶液能导电,故SO2为电解质
B.阳离子在反应中只能得电子被还原作氧化剂
C.标准状况下,6.72L的NH3的物质的量为0.3mol
D.氯水、液氨、空气、盐酸都是混合物
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法不正确的是
A.标准状况下,11.2L的CHCl3所含的分子数为0.5NA
B.28g乙烯所含共用电子对数为6NA
C.2.8g的聚乙烯中含有的碳原子数为0.2NA
D.1mol乙烯中同一平面的原子有6NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种用途广泛的香料,可用烃A与有机物E为原料,按照如下流程进行合成。已知A在标准状况下的密度为1.25 g·L-1。
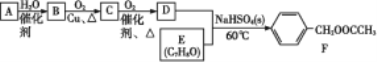
回答下列问题:
(1)有机物F中含有的官能团名称为____。
(2)A生成B的反应类型为________。
(3)写出流程中B生成C的化学方程式_______。
(4)下列说法正确的是____。
A 流程图中有机物B转化为C,Cu参与了化学反应,但反应前后的质量保持不变
B 有机物C不可能使溴水褪色
C 有机物D、E生成F的反应为酯化反应,本质上是取代反应
D 合成过程中原子的理论利用率为100%的反应只有一个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还蕴藏着丰富的矿产,海水中含有大量的化学物质,是宝贵的化学资源。海水素有“液体工业原料”的美誉,可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质。下面是海水综合利用的部分流程:

完成下列问题:
(1)下列说法错误的是________(填标号)。
A.电解饱和食盐水时阳极的电极反应式为:Cl2+2e-===2Cl-
B.苦卤制溴过程一定发生氧化还原反应
C.操作Ⅰ是蒸发结晶
D.E物质可以循环使用
(2)沉淀剂A来源于石灰窑厂,写出A的化学式:A_______________。
(3)实验室提纯粗盐的实验操作依次为:取样、________、沉淀、过滤、________。
(4)工业生产纯碱的工艺流程中,碳酸化时产生的现象为___________,发生反应的化学方程式是____________,其原因是______________。
(5)碳酸化后过滤,滤液D最主要的成分是________(填写化学式),检验这一成分的阴离子的具体方法是___________。向滤液D中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是________(填标号),这样做可使原料氯化钠的利用率从70%提高到90%以上。
a.增大NH![]() 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(6)用加热分解的方法测定产品纯碱的纯度,若取m1 g纯碱样品,实验结束后称得固体质量为m2 g,则纯碱的纯度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表示正确的是( )
a.体积:②>③>①>④ b.密度:②>③>④>①
c.质量:②>③>①>④ d.氢原子个数:①>③>④>②
A.abcB.bcdC.abcdD.acd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伞形酮可用作荧光指示剂和酸碱指示剂,其合成方法为: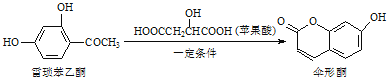 ,下列有关这三种物质的说法正确的是( )
,下列有关这三种物质的说法正确的是( )
A. 每个雷琐苯乙酮、苹果酸和伞形酮分子中均含有1个手性碳原子
B. 雷琐苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应
C. 1 mol雷琐苯乙酮跟足量H2反应,最多消耗3molH2
D. 1 mol伞形酮与足量NaOH溶液反应,最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:________(填元素符号),
(2)在最高价氧化物对应的水化物中,碱性最强的化合物是________(填化学式),在常温下该化合物和元素⑦的单质反应的离子方程式__________。
(3)用电子式表示元素④与⑥的化合物的形成过程:__________。
(4)表示①与⑦的化合物的电子式_______,该化合物是由______(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是____________(用化学式表示)。
II.①CBr2;②H2O;③NH4Cl;④H2O2;⑤Na2O2;⑥Ca(OH)2;⑦HClO;⑧I2;⑨He
只含有离子键的是(用序号回答)_____,即含离子键又含共价键是(用序号回答)_____,其中含有非极性共价键的共价化合物是(用序号回答)_____,常温时为固体,当其熔化时,不破坏化学键的是(用序号回答)_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com