
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
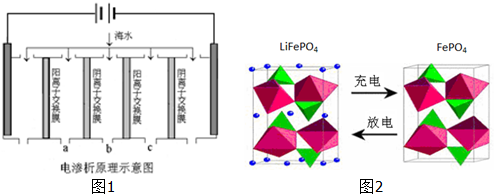
| ||
| 1L |


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
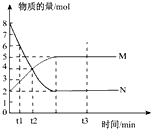
A、化学方程式中
| ||
| B、t2时N 的 v正=v逆. | ||
C、从t1到t2时刻 M的平均反应速率
| ||
| D、t3时混合气体的总物质的量不随时间的变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、35.5:108 |
| B、l:2 |
| C、108:35.5 |
| D、8:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L乙醇中含有的氧原子数为NA |
| B、标准状况下,1.12L16O2和1.12L18O2均含有0.1NA个氧原子 |
| C、在Na2O2与水的反应中,生成lmolO2转移的电子数为 4×6.02×1023 |
| D、25℃时,pH=13的Ba(OH)2溶液中含有OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质A、B的转化率之比为a:b | ||
| B、当v正(A)=2v逆(B)时,可确定反应达到平衡 | ||
C、起始时刻和达到平衡后容器中的压强比为(a+b):(a+b-
| ||
| D、若起始时放入2a mol A和2b mol B,则达到平衡时生成2n mol C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com