
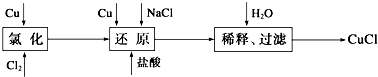
| 0.896L |
| 22.4L/mol |
| 0.896L |
| 22.4L/mol |
 ;
; ;
;
| ||
| ||


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
| A、氧化物:CO2 NO SO2 H2O |
| B、碱:NaOH KOH Ba(OH)2 Na2CO3 |
| C、铵盐:NH4Cl NH4NO3 (NH4)2SO4 NH3?H2O |
| D、碱性氧化物:Na2O CaO Mn2O7 MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石英与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| B、硅与烧碱溶液反应:Si+2OH-+H2O═SiO32-+2H2↑ |
| C、向小苏打溶液中加入过量的石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| D、往水玻璃中加入盐酸:2H++SiO32-═H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从元素周期表中可以获取元素名称、原子序数、相对原子质量等信息 |
| B、物质本身没有好与坏之分,而人们对物质的应用却存在合理与不合理之分 |
| C、对于化学变化,根据不同的需求,人们需要控制反应条件促进或抑制反应的发生 |
| D、科学家创建元素符号、化学方程式等化学用语,是为了增加化学科学的神秘色彩 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜是一种紫红色金属 |
| B、铜是热和电的良导体 |
| C、铜在自然界中主要以单质的形式存在 |
| D、铜是人类使用最早、应用最广泛的金属之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
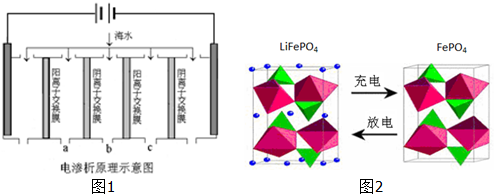
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、①④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A、反应的速率:③>①>② |
| B、达到平衡时氨气的浓度:①>② |
| C、放出的热量(kJ):a<b<92.4 |
| D、反应得到1mol NH3(l),放出热量46.2kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com