
【题目】一定温度下,将1mol PCl5通入一个容积固定不变的密闭容器中,发生反应:PCl5(g) ![]() PCl3(g) + Cl2(g),反应达到平衡时,测得PCl5为0.4mol,此时再向容器中通入1mol PCl5,同样温度下再达到平衡时,测得PCl5为amol,下列判断正确的是
PCl3(g) + Cl2(g),反应达到平衡时,测得PCl5为0.4mol,此时再向容器中通入1mol PCl5,同样温度下再达到平衡时,测得PCl5为amol,下列判断正确的是
A. Cl2的体积分数增大 B. PCl5的分解率增大
C. a = 0.8 D. a > 0.8
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】某矿样用过量酸溶解并过滤,所得滤液A主要含CO32-、Ni2+、SO42-、H+、Fe2+、Fe3+、OH-、Mg2+、Mn2+等九种离子中的七种。将A中金属元素进行分离以备利用,部分流程如图所示:
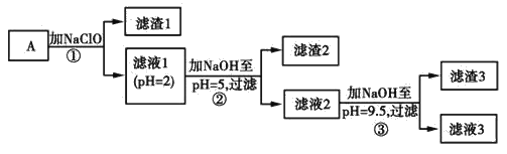
可能用到的有关数据如下:
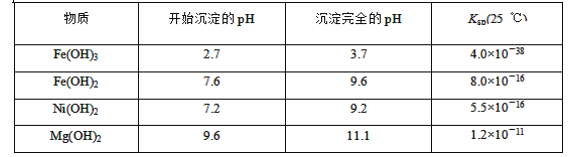
请根据题给信息填空:
(1)滤液A中不能大量存在的两种离子是________。
(2)已知“滤渣1”是MnO2,步骤①发生的氧化还原反应的离子方程式为________。
(3)常温下,某Ni(OH)2、Mg(OH)2共沉淀的混合体系中,若c(Ni2+)=5.5×10-11mol·L-1,则c(Mg2+)=________。
(4)假定步骤①中NaClO恰好反应,欲检验滤液3中的酸根离子,需优先检验________(填离子符号)。
(5)为测定该矿样中铁元素的含量,取20.0 g矿石,按上述流程操作,将________(填“滤渣1”、“滤渣2”或“滤渣3”)完全酸溶,再使其中的铁元素还原为Fe2+,然后将所得溶液稀释到100 mL,取出20.00 mL用0.100 0 mol·L-1KMnO4溶液滴定。达到滴定终点时溶液颜色为________色,共消耗KMnO4溶液16. 00 mL,经计算矿样中铁元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用已知浓度的盐酸来测定某氢氧化钠样品的纯度(杂志不参与反应),试根据实验回答下列问题:
(1)准确称量5.0 g含有少量易溶杂质的样品,配成1L待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.100 0 mol·L-1的盐酸来滴定待测溶液,可选用________作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中氢氧化钠溶液放在锥形瓶中,则盐酸应该放在_______(填“甲”或“乙”)中。该同学选用酚酞做指示剂,如何判断达到滴定终点:_______________________________。

(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是______________ mol·L-1,烧碱样品的纯度是_______________。
滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 10.50 |
第二次 | 10.00 | 4.10 | 14.00 |
第三次 | 10.00 | 2.50 | 14.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始平视,滴定终点俯视,则滴定结果______________。
②滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失,则滴定结果______________。
③洗涤后锥形瓶未干燥,则滴定结果______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1 mol/L的NH4HCO3溶液,pH =7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是

A. 常温下Kb(NH3·H2O)> Kal(H2CO3)
B. 向pH =6.5的上述溶液中逐滴滴加NaOH溶液时,NH4+和HCO3一浓度都逐渐减小
C. NH4HCO3溶液中存在下列守恒关系:c( NH4+) +c( NH3·H2O) =c(HCO3-)+c(CO3 2-)+c( H2 CO3)
D. 当溶液的pH =9时,溶液中存在下列关系:c(HCO3-)>c(NH4+>c(NH3·H2O)>c(CO3 2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。请回答下列问题:
(1)Z3+离子的核外电子排布式是_______。
(2)科学家成功地在高压下将XY2转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是_______;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是_______。(填化学式)
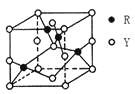
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是_______。
(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是_______。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及现象能够达到对应实验目的是( )
选项 | 实验操作及现象 | 实验目的 |
A | 向溶液中加入盐酸无现象,再加入氯化钡溶液产生白色沉淀 | 检验溶液中有 |
B | 常温下,向饱和 | 证明常温下, |
C | 常温下,测定盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于 |
D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时将浓度均为0.1mol·L-1、体积分别为Va和Vb的HA 溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示,下列说法正确的是
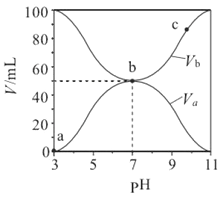
A. a→c 过程中水的电离程度始终增大
B. b点时,c(B+)=c(A-)=c(H+)=c(OH-)
C. c点时, 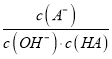 随温度升高而减小
随温度升高而减小
D. 相同温度下,Ka(HA)>Kb(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K、1.01×105Pa下,将22gCO2通入750mL1molL-1NaOH溶液中充分反应,测得反应放出xkJ的热量。已知该条件下,将1molCO2通入1L2molL-1NaOH溶液中充分反应放出ykJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJmol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y)kJmol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJmol-1
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) ΔH=-(4x-2y)kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。(室温下,H2CO3的Ka1=4.3×10﹣7;Ka2=5.6×10﹣11)
(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。写出电极A发生的电极反应式___。

(二)CO2的综合利用
(1)CO2与CH4经催化重整制得合成气:
反应Ⅰ.CH4(g)H+CO2(g)2CO(g)+2H2(g)△H1
已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示
物质 | H2(g) | CO(g) | CH4(g) |
标准燃烧热△H/kJmol﹣1 | ﹣285.8 | ﹣283.0 | ﹣890.3 |
则反应I的△H=___kJmol﹣1。
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),在10L恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。

①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0
B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是Ce
C.状态d时,v(正)<v(逆)
D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com