
【题目】在25℃时,密闭容器中X,Y,Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
【答案】C
【解析】解:A.反应达到平衡时,X的转化率为: ![]() =50%,故A正确;B.根据反应速率之比等于浓度变化量之比等于化学计量数之比可知:△c(X):△c(Y):△c(Z):=0.05:0.15:0.1=1:3:2,
=50%,故A正确;B.根据反应速率之比等于浓度变化量之比等于化学计量数之比可知:△c(X):△c(Y):△c(Z):=0.05:0.15:0.1=1:3:2,
则反应的方程式为X+3Y2Z,K= ![]() =
= ![]() =1600(mol/L)﹣2 , 故B正确;
=1600(mol/L)﹣2 , 故B正确;
C.增大压强平衡向生成Z的方向移动,但平衡常数不变,故C错误;
D.平衡常数只受温度的影响,温度改变时,化学平衡常数一定变化,故D正确.
故选C.
A.根据转化率= ![]() 计算;
计算;
B.根据反应速率之比等于化学计量数之比判断化学方程式并计算平衡常数;
C.增大压强,化学平衡常数不变;
D.平衡常数只受温度的影响.


科目:高中化学 来源: 题型:
【题目】人类生产、生活中处处都有化学的身影,下列说法正确的是( )
A.燃放焰火必然会发生化学反应,故焰色反应属于某些金属元素的化学性质
B.水蒸气的液化、煤的液化都属于物质状态的改变,都属于物理变化
C.玻璃属于混合物、水玻璃属于纯净物
D.利用厨房中的食醋和纯碱可证明醋酸酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列类比关系正确的是( )
A.AlCl3与过量NaOH溶液反应生成AlO ![]() ,则与过量NH3?H2O也生成AlO
,则与过量NH3?H2O也生成AlO ![]()
B.Na2O2与CO2反应生成Na2CO3和O2 , 则与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3 , 则与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。请回答:
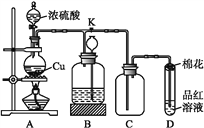
(1)装置A中发生反应的化学方程式为_______________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中长颈漏斗内液面上升,广口瓶内液面下降,则B中应放置的液体是(填字母)___。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和V L 18 mol·L-1硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_____________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是__(填字母)。
A.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
③实验结束时测得铜减少了3.2 g,则被还原的硫酸的物质的量为_____mol;转移的电子为_____mol;反应后溶液中硫酸根离子的物质的量浓度为_________mol·L-1。(反应后溶液的体积为V L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
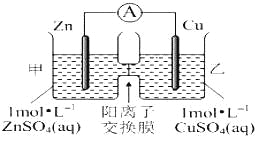
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊的相关信息卡片如图所示:

(1)铊的原子序数为81,铊在元素周期表中位于第________周期,第________族。
(2)下列推断正确的是________。
A.单质的还原性:Tl>Al
B.原子半径:Al>Tl
C.碱性:Al(OH)3>Tl(OH)3
D.氧化性:Tl3+>Al3+
(3)铊(Tl)是某超导材料的组成元素之一。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag===Tl++2Ag+。下列推断正确的是________。
A.Tl+最外层有1个电子
B.Tl能形成+3价和+1价的化合物
C.Tl3+的氧化性比Ag+弱
D.Tl+的还原性比Ag强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为 .
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
(4)已知:
N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
2H2(g)+O2(g)=2H2O(l)=﹣571.6kJmol﹣1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属的说法不正确的是![]()
A. 均为ⅠA族元素,最外层均有1个电子
B. 单质的还原性: ![]()
C. 碱性: ![]()
D. 由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于定量实验中的基本操作和仪器的描述正确的是( )
A.用托盘天平称取20.00 g NaOH固体
B.用碱式滴定管准确量取20.00 mL K2Cr2O7溶液
C.用电子(分析)天平测得铁片质量是15.524 g
D.在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,此时再加入蒸馏水使其液面与刻度线持平
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com