
【题目】下列类比关系正确的是( )
A.AlCl3与过量NaOH溶液反应生成AlO ![]() ,则与过量NH3?H2O也生成AlO
,则与过量NH3?H2O也生成AlO ![]()
B.Na2O2与CO2反应生成Na2CO3和O2 , 则与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3 , 则与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
科目:高中化学 来源: 题型:
【题目】为了检验SO42-,甲、乙、丙、丁四位同学设计了如下四种方案,其中方案最优的是( )
A. 方案甲:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B. 方案乙:试液![]() 白色沉淀
白色沉淀![]() 沉淀不溶解
沉淀不溶解
C. 方案丙:试液![]() 白色沉淀
白色沉淀![]() 沉淀不溶解
沉淀不溶解
D. 方案丁:试液![]() 无沉淀(也无气泡)
无沉淀(也无气泡)![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的操作正确的是( )
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.检验某溶液是否含有SO ![]() 时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
C.为观察Mg条在CO2气体中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部
D.用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列结论均出自《实验化学》中的实验,其中错误的是( )
A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘
B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据
C.镀锌铁皮发生电化学腐蚀时,锌发生氧化反应
D.食醋的总酸含量是指食醋中醋酸的总物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H为八种相邻的短周期元素,其单质的沸点如图所示.
请回答:
①上述元素中,某些元素与氢元素形成的含有十个电子的阳离子中含有配位键,请写出其离子、(填化学式).
②已知D、F、G三种元素的离子具有跟E相同的电子层结构,则B、C、D三种元素的电负性由大到小的顺序为(用相关元素符号表示) . F、G、H三种元素的第一电离能由大到小的顺序为(用相关元素符号表示) .
③已知H的电负性为1.5,而氯元素的电负性为3.0,二者形成的化合物极易水解,且易升华.据此推测该化合物的化学键类型为 . 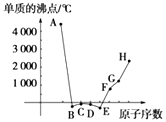
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X,Y,Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的铜片与![]() 浓硫酸加热充分反应,收集到标准状况下的
浓硫酸加热充分反应,收集到标准状况下的![]() 气体VL,下列对此反应的有关说法中错误的是
气体VL,下列对此反应的有关说法中错误的是 ![]()
A. 该反应体现了浓硫酸的酸性和强氧化性
B. 反应结束后两种反应物均有剩余
C. 被还原的硫酸为![]()
D. 参加反应的Cu为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com