
����Ŀ�����ݻ�Ϊ2.00 L����������ͨ��һ������N2O4��������ӦN2O4(g)2NO2(g)�����¶�����������������ɫ����ش��������⣺

(1)��Ӧ����H________0(��������������С����)��100 ��ʱ����ϵ�и�����Ũ����ʱ��仯����ͼ��ʾ����0��60 sʱ������Ӧ��ƽ�ⳣ��K1Ϊ________��
(2)100 ��ʱ��ƽ���������Ӧ�������ݻ�����һ����ƽ����________(��������Ӧ�������淴Ӧ��)�����ƶ����ﵽ�µ�ƽ���N2O4��Ũ�ȷ�Χ��___________________
���𰸡� ���� 0.36 �淴Ӧ 0<c��N2O4��< 0.02 mol/L
��������(1)���¶ȵ����ߣ�����������ɫ���˵�������¶�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ������H��0��K=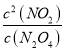 =
=![]() =0.36���ʴ�Ϊ�����ڣ�0.36��
=0.36���ʴ�Ϊ�����ڣ�0.36��
(2)100 ��ʱ��ƽ�����Ӧ�������ݻ�����һ���������ѹǿ��С��ƽ�������ƶ���������������ԭ�����ﵽ�µ�ƽ���N2O4��Ũ�ȷ�ΧΪ0<c(N2O4)< 0.02mol/L���ʴ�Ϊ������Ӧ��0<c(N2O4)< 0.02mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ijͬѧ�����һ��ȼ�ϵ�ز�̽���ȼҵԭ�������������������װ����XΪ�����ӽ���Ĥ���밴Ҫ��ش����������

(1)ʯī�缫(C)��________�������м���ȼ�ϵ�صĸ�����ӦʽΪ______________________________��
(2)������2.24 L(���)����������װ�������缫�����ɵ��������(���)Ϊ________ L��
(3)������CuSO4��ҺΪ�������Һ���д�ͭ(��Al��Zn��Ag��Pt��An������)�ĵ�⾫��������˵����ȷ����________(����ĸ)��
A��a�缫Ϊ��ͭ
B����ͭ�ӵ�Դ������������ԭ��Ӧ
C��CuSO4��Һ��Ũ�ȱ��ֲ���
D������������ɻ���Ag��Pt��Au�Ƚ���
(4)��������ϡH2SO4Ϊ�������Һ���缫����bΪ��������ʹ����������һ�����ܵ�����Ĥ���õ缫��ӦʽΪ__________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�У��ܹ�˵���������Ϊ��������ṹ��������ƽ�������νṹ����
A����������е�C��H����ȫ��ͬ
B��������ӵĽṹ���жԳ���
C��������ӵĶ��ȴ���ֻ��һ�ֽṹ
D���������ΪCHCl3�����ʾ��й̶����ۡ��е�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����У����������ַ���������������ͬ����
A. HCl B. N2 C. CO D. C2H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʰ��յ���ʡ��ǵ���ʡ��������˳�����е���
A. ��ˮ����� �ɱ� ������ B. ���� �Ҵ� ��ˮ
C. ���� SO2 ���� D. �Ȼ��ƹ��� Һ�� BaSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaCl��NaBr��NaI��NaS��Һ����ѡ�õ��Լ���
A. ��ˮ B. AgNO3��Һ C. �� D. FeCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ԲȦ�ཻ�IJ��ֱ�ʾԲȦ�ڵ��������Ӧ����֪����������������ʵ�����Ϊ0.1 mol��ˮ������Ϊ100 g������˵����ȷ����
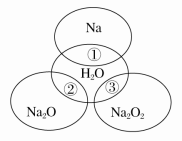
A����Ӧ������ܲ���0.05 mol O2
B����Ӧ�������ӷ���ʽΪNa��2H2O==Na����2OH����H2��
C��Na2O2������������Ŀ֮��Ϊ1��1
D��������������ַ�Ӧ��������Һ�����ʵ�������������>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������λ�������������������Ϳ�ѧʵ����Ӧ�ù㷺��
��1��һ��������Fe2O3����鷴Ӧ��ȡ��������ͬʱ����CO��H2��
��֪��Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) ��H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) ��H=-41.0kJ/mol
�ٷ�ӦFe2O3(s)+3 CH4(g)![]() 2Fe(s)+3CO(g) +6H2(g)�ġ�H______0���>������<����=����
2Fe(s)+3CO(g) +6H2(g)�ġ�H______0���>������<����=����
�����÷�Ӧ��5L���ܱ������н��У�1min��ﵽƽ�⣬�����ϵ�й�����������0.96g����ö�ʱ����CO��ƽ����Ӧ����Ϊ__________��
�����÷�Ӧ�ں��º�ѹ�����н��У��ܱ����÷�Ӧ�ﵽƽ��״̬����______(ѡ�����)
a��c(CH4)=c(CO)
b�����������������
c��v(CO)��v(H2)�ı�ֵ����
d����������ƽ����Է�����������
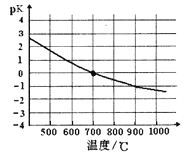
�ܸ÷�Ӧ�Ļ�ѧƽ�ⳣ���ĸ�����pK�淴Ӧ�¶�T�ı仯��������ͼ������ƽ���ƶ�ԭ���������ߵı仯���ɣ�______________________����700��ʱ���cƽ��(H2)=1.0mol��L-1����CH4��ת����Ϊ_________��
(2)���������Ҫ�ɷ��ǣ�FeCO3��ʵ�����п���ͨ��FeSO4��NaHCO3��Һ����Ƶ�FeCO3���йط�Ӧ�����ӷ���ʽΪ��____________________����֪Ksp[FeCO3]=3.2��10-11��H2CO3��Ka1=4.30��10-7��Ka2=5.61��10-11����ͨ���������ݼ�Ҫ����˵���÷�Ӧ�ܽ��е�ԭ��_____________________��
(3)Na2FeO4��һ�ָ�Ч��ˮ������ҵ����FeΪ������NaOHΪ�������Һ���е���Ʊ��� д�������缫��Ӧʽ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���Ļ�Խ����ƺͼ�֮�䣬����������ȷ���ǣ� ��
A. ����ˮ��Ӧ��������ˮ��Ӧ����
B. �����Դ�KCl��Һ���û�����
C. �����ԣ�K��>Ba2��>Na��
D. ���ԣ�KOH>Ba��OH��2>NaOH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com