
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H0(填“>”、“=”或“<”);
②某温度下,将2molCO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 .
(3)要提高CO的转化率,可以采取的措施是 . a.升温b.加入催化剂c.增加CO的浓度
d.加入H2加压e.加入惰性气体加压f.分离出甲醇
(4)一定条件下,CO与H2在催化剂的作用下生成5molCH3OH的能量变化为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
平 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ | |
体系压强(Pa) | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
下列说法正确的是 .
A.2c1>c3
B.a+b<90.8
C.2p2<p3
D.α1+α3<1.
【答案】
(1)CD
(2)<;80%;250℃
(3)df
(4)D
【解析】解:(1)A.生成CH3OH的速率与消耗CO的速率均表示正反应速率,反应始终按该比例关系进行,故A错误;
B.混合气体总质量不变,容器容积不变,混合气体的始终密度不变,故B错误;
C.混合气体总质量不变,随反应进行混合气体总物质的量减小,平均相对分子质量减小,混合气体的相对平均分子质量不变,说明到达平衡,故C正确;
D.CH3OH、CO、H2的浓度都不再发生变化,说明到达平衡,故D正确,
故选:CD;(2)①由表数据可知,温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正向放热反应,即△H1<0,所以答案是:<;
②充分反应达到平衡后,测得c(CO)=0.2mol/L,其物质的量为2L×0.2mol/L=0.4mol,则:
CO (g)+ | 2H2 (g) | CH3OH (g) | |
起始(mol) | 2 | 6 | 0 |
转化(mol) | 1.6 | 3.2 | 1.6 |
平衡(mol) | 0.4 | 2.8 | 1.6 |
CO的转化率= ![]() ×100%=80%,
×100%=80%,
此时的平衡常数K= ![]() =
= 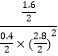 ≈2.041,所以温度为250℃,
≈2.041,所以温度为250℃,
所以答案是:80%;250℃;(3)a.正反应为放热反应,升温平衡逆向移动,CO转化率减小,故a错误;
b.加入催化剂加快反应速率,但不影响平衡移动,CO转化率不变,故b错误;
c.增加CO的浓度,CO转化率减小,故c错误;
d.加入H2加压,平衡正向移动,CO转化率增大,故d正确;
e.加入惰性气体加压,恒温恒容下平衡不移动,CO转化率不变,故e错误;
f.分离出甲醇,平衡正向移动,CO转化率增大,故f正确,
故选:df;(4)A.甲、丙相比较,把甲等效为开始加入1molCH3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH3OH(g)CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2c1<c3,故A错误;
B.由题目可知生成1molCH3OH的能量变化为 ![]() =90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,a=90.8n,等于乙容器b=90.8(1﹣n),故a+b=90.8,故B错误;
=90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,a=90.8n,等于乙容器b=90.8(1﹣n),故a+b=90.8,故B错误;
C.比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2p2>p3,故C错误;
D.甲、乙处于相同的平衡状态,则α1+α2=1,由C的分析可知α2>α3,所以a1+a3<1,故D正确,
所以答案是:D.
【考点精析】利用化学平衡状态本质及特征和化学平衡状态的判断对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温泉有远古“圣水”之誉,富含各种对人体有益的微量元素及矿物质,水温高达56℃,水质淡黄清澈,享有“一盆玉汤”的美誉,对治疗皮肤病、色斑、关节炎及神经衰弱等有特殊的疗效.下列元素在生物体内含量较少,但对维持生物体正常生命活动必不可少的元素是( )
A. Fe Mn Zn Mg B. Zn Cu Mg Ca C. Zn Cu B Mn D. Mg Mn Cu Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酶和ATP的叙述,错误的是( )
A. ATP中的A代表腺嘌呤,T代表 3,P代表磷酸基团
B. ATP 脱去2个磷酸基团后是RNA的基本组成单位之一
C. 酶促反应速率往往受温度、pH和底物浓度等因素的影响
D. 人体内的酶不能通过食物获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O![]() 2H++ 2CrO42-(黄色)
2H++ 2CrO42-(黄色)
①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+ = 2Cr3+(绿色) + 6Fe3+ + 7H2O。
下列分析正确的是
A. 实验①和②均能证明K2Cr2O7溶液中存在上述平衡
B. 实验②能说明氧化性:Cr2O72-> Fe3+
C. CrO42-和Fe2+在酸性溶液中可以大量共存
D. 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL,回答下列问题:

(1)电源F是__________极;
(2)A池的第②极上的电极反应式_________
(3)通电前A池中原混合溶液Cu2+的浓度________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。工业上,利用乙烯水化法制乙醇:CH2=CH2+H2O![]() CH3CH2OH。下列有关说法正确的是
CH3CH2OH。下列有关说法正确的是
A. 1mol乙烯和1mol乙醇分别完全燃烧,消耗O2的分子数均为3NA
B. 1mol H2O和H2F+的混合物中所含质子数为10NA
C. 乙醇催化氧化生成1mol乙醛时转移电子数为NA
D. 46g乙醇中所含共价键的数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣1 025kJmol﹣1是一个可逆反应.若反应物起始物质的量相同,则如图中关于该反应不正确的是( )
A.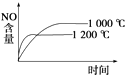
B.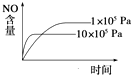
C.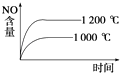
D.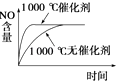
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com