
【题目】如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL,回答下列问题:

(1)电源F是__________极;
(2)A池的第②极上的电极反应式_________
(3)通电前A池中原混合溶液Cu2+的浓度________
【答案】 正 4OH--4e-===2H2O +O2↑ 0.025 mol·L-1
【解析】分析:通电5min后,第③极增重,所以第③极是阴极,则F是电源正极,第②极是阳极;根据阴阳极上转移电子守恒计算硫酸铜的物质的量浓度。
详解:(1)通电5min后,第③极增重,所以第③极是阴极,则F是电源正极,第②极是阳极;
(2)第②极是阳极,A中阳极上氢氧根离子放电生成氧气,其电极反应式为:4OH--4e-=2H2O+O2↑;
(3)第③极反应为Ag++e-=Ag,n(Ag)=2.16g÷108g/mol=0.02mol,则转移的电子为0.02mol。A池中阳极反应为4OH--4e-=2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL<224mL,所以在阴极上还有氢气生成,体积是112mL,氢气的物质的量为0.005mol,由2H++2e-=H2↑可知转移电子是0.01mol,则铜离子得到的电子是0.02mol-0.01mol=0.01mol,由Cu2++2e-=Cu可知Cu2+的物质的量为0.005mol,因此通电前c(CuSO4)=0.005mol÷0.2L=0.025 molL-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】生物大分子在生物体的生命活动中具有重要的作用,碳原子本身的化学性质,是它能够通过化学键连接成链或环,从而形成各种生物大分子。可以说,地球上的生命处在碳元素的基础上建立起来的。以上事实可以说明
A. 碳元素组成各种各样的化合物 B. 碳元素是生命的最基本元素
C. 碳元素是各种大分子中含里最多的元素 D. 碳元聚比其他元素重耍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
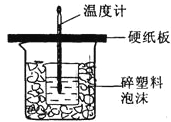
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。
(2)烧杯间填满碎纸条的作用是___________________。
(3)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等、不相等”)。所求中和热__________(填“相等、不相等”)。简述理由__________________________________________________。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________(填“偏大”、“偏小”、“无影响”)。
(5)利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-42.3kJ·mol-1
甲烷和水蒸气生成二氧化碳和氢气的热化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H0(填“>”、“=”或“<”);
②某温度下,将2molCO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 .
(3)要提高CO的转化率,可以采取的措施是 . a.升温b.加入催化剂c.增加CO的浓度
d.加入H2加压e.加入惰性气体加压f.分离出甲醇
(4)一定条件下,CO与H2在催化剂的作用下生成5molCH3OH的能量变化为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
平 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ | |
体系压强(Pa) | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
下列说法正确的是 .
A.2c1>c3
B.a+b<90.8
C.2p2<p3
D.α1+α3<1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol/L.对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol(Lmin)﹣1
B.分别用B,C,D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol(Lmin)﹣1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法不正确的是( ) 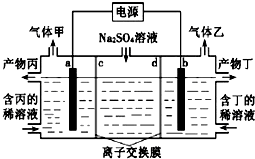
A.a极与电源的正极相连
B.产物丙为硫酸溶液
C.离子交换膜d为阳离子交换膜(允许阳离子通过)
D.a电极反应式为2H2O+2e﹣═2OH﹣+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com