
【题目】利用水热和有机溶剂等软化学方法,可合成出含有有机杂化锌、锗以及砷等金属的硒化物,且该硒化物具有离子交换、催化、吸附、半导体等性能,显示出良好的应用前景。回答下列问题:
(1)锌基态原子核外电子排布式为:___________________。
(2)元素锗与砷中,第一电离能较大的是:___________________(填元素符号)。
(3)SeO32-离子中Se原子的杂化形式为:_____________,气态SeO3分子的立体构型为:__________,与SeO3互为等电子体的一种离子为:_________________。(填离子符号)。
(4)硒化锌是一种重要的半导体材料,其晶胞结构如下图所示(a代表Zn,b代表Se),该晶胞中Se原子周围与之紧邻的其他Se原子数为:_______________________。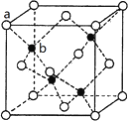
【答案】 1s22s22p63s23p63d104s2或[Ar]3d104s2 As sp3 平面三角形 CO32-(或NO3-) 12
【解析】(1)锌为30号元素,基态原子核外电子排布式为1s22s22p63s23p63d104s2,故答案为:1s22s22p63s23p63d104s2;
(2)元素锗与砷是同一周期元素,由于As的4p为半充满状态,第一电离能较大,故答案为:As;
(3)SeO32-离子中Se原子的价层电子对数=3+![]() ×(6+2-2×3)=4,采用sp3杂化;气态SeO3中Se原子的价层电子对数=3+
×(6+2-2×3)=4,采用sp3杂化;气态SeO3中Se原子的价层电子对数=3+![]() ×(6-2×3)=3,采用sp2杂化,立体构型为平面三角形;与SeO3互为等电子体的一种离子为CO32-(或NO3-),故答案为:sp3;平面三角形;CO32-(或NO3-);
×(6-2×3)=3,采用sp2杂化,立体构型为平面三角形;与SeO3互为等电子体的一种离子为CO32-(或NO3-),故答案为:sp3;平面三角形;CO32-(或NO3-);
(4)硒原子在晶胞内,该晶胞中含有硒原子数为4,该晶胞中含有锌原子数为8×![]() +6×
+6×![]() =4,化学式为ZnSe,且Se原子和Zn原子的配位数相等,均为4,则晶胞中Se原子周围与之紧邻的其他Se原子数与Zn原子周围与之紧邻的其他Zn原子数相等,根据晶胞结构图,位于顶点的Zn原子周围与之紧邻的其他Zn原子位于面心,在每个晶胞中含有3×
=4,化学式为ZnSe,且Se原子和Zn原子的配位数相等,均为4,则晶胞中Se原子周围与之紧邻的其他Se原子数与Zn原子周围与之紧邻的其他Zn原子数相等,根据晶胞结构图,位于顶点的Zn原子周围与之紧邻的其他Zn原子位于面心,在每个晶胞中含有3×![]() =
=![]() ,而每个顶点被8个晶胞共用,则Zn原子周围与之紧邻的其他Zn原子数=
,而每个顶点被8个晶胞共用,则Zn原子周围与之紧邻的其他Zn原子数=![]() ×8=12,因此Se原子周围与之紧邻的其他Se原子数为12,故答案为:12。
×8=12,因此Se原子周围与之紧邻的其他Se原子数为12,故答案为:12。


科目:高中化学 来源: 题型:
【题目】为了缓解温室效应,科学家提出了多种回收和利用CO2的方案。
方案I:利用FeO吸收CO2获得H2
ⅰ.6FeO(s)+CO2(g)=--2Fe3O4(s)+C(s) △H1=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g) △H2=+113.4kJ/mol
(1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H3=________。
(2)在反应i中,每放出38.0kJ热量,有_______gFeO被氧化。
方案II:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2molCO2和8molH2,发生反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。
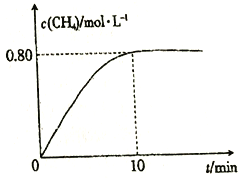
(3) ①从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)=_________。
②300℃时,反应的平衡常数K=____________。
③保持温度不变,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度_________(填字母)。
A.等于0.8mol/L B.等于1.6 mol/L C.0.8 mol/L <c(CH4)<1.6 mol/L D.大于1.6 mol/L
(4)300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g),则v正____v逆(填“>”“<”或“=”)。
(5)已知:200℃时,该反应的平衡常数K=64.8L2·mol-2。则△H4______0(填“>”“<”或“=”)。
方案Ⅲ:用碱溶液吸收CO2
利用100mL3mol/LNaOH溶液吸收4.48LCO2(标准状况),得到吸收液。
(6)该吸收液中离子浓度的大小排序为______________。将该吸收液蒸干、灼烧至恒重,所得固体的成分是__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。

(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘具有“智力元素”之称.体内缺碘会影响神经系统发育,造成智力损害.食用碘盐可以防止碘缺乏病.碘盐中加入的物质是( )
A.I2
B.KI
C.KIO3
D.NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是( )
A. 可用托盘天平和小烧杯称取 10.2 g NaOH固体
B. 某实验需要 900 mL 0.1 mol/L的硫酸铜溶液,则配制该溶液需称取 22.5 g 胆矾晶体
C. 用 10 mL 量筒量取 5.2 mL 硫酸,仰视时实际量得的液体体积大于 5.2 mL
D. 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
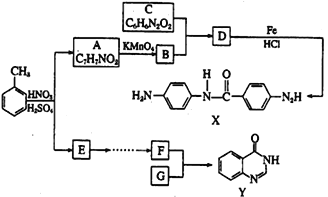
【题目】某研究小组从甲苯出发,按下列路线合成染料中间体X和医药中间体Y。
己知:①化合物A、E、F互为同分异构体。
②![]() (易被氧化)
(易被氧化)
③![]()
(1)X中的官能团名称为:___________和___________。
(2)A→B的反应类型为:___________。
(3)B+C→D的化学方程式是:________________________________。
(4)G的结构简式为:___________。
(5)写出同时满足下列条件的E的一种同分异构体的结构简式: ________________。
①红外光谱检测表明分子中含有醛基和羟基;
②1H-NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子。
(6)为探索新的合成路线,采用苯和乙烯为原料制备化合物F,请写出该合成路线的流程图(无机试剂可任选,合成路线流程图示见本题题干)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:lg C(s)燃烧生成一氧化碳放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述不正确的是 ( )

A. 碳[C(s)]的燃烧热△H< -110.4kJ·mol-1
B. 1mol CuO分解生成Cu2O吸收73kJ的热量
C. 2Cu2O(s)+O2(g)=4CuO(s) △H=-292 kJ·mol-1
D. 足量炭粉与CuO反应生成Cu2O的热化学方程式为:C(s)+2CuO(s)=Cu2O(s) +CO(g) △H= -35.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列叙述中,正确的说法有几项 ( )

①Mg(s)所具有的能量高于MgX2(s)所具有的能量
②MgCl2电解制Mg(s)和Cl2(g)是吸热过程
③热稳定性:MgI2>MgBr2>MgCl2>MgF2
④常温下氧化性:F2<Cl2<Br2<I2
A. 1项 B. 2项
C. 3项 D. 4项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com