
 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素.请用化学用语回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素.请用化学用语回答下列问题: ,
, ;
;

科目:高中化学 来源: 题型:
| A、电镀过程中氢气在镀件表面析出 |
| B、电镀时溶液中Cu2+移向阴极,并在阴极上发生还原反应 |
| C、阳极反应式为HCHO+3OH--2e-=2H2O+HCOO- |
| D、电镀时每生成6.4g铜,镀层放出2.24L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu、CH3C00H、酒精 |
| B、NaCl、BaSO4、SO2 |
| C、KNO3、NH3?H2O、CaCO3 |
| D、氯化钠晶体、水、酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g金属镁变为镁离子时失去的电子数为0.2NA |
| B、1 mol?L-1KCl溶液中含有Cl-的个数为NA |
| C、在常温常压下,18 g水中含有的分子数为NA |
| D、在常温常压下,11.2L N2含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
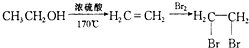
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有卤代烃是难溶于水,比水重的液体 |
| B、所有卤代烃在适当条件下都能发生消去反应 |
| C、所有卤代烃都含有卤素原子 |
| D、所有卤代烃都是通过取代反应制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往碳酸镁固体中滴加稀盐酸:CO32-+2H+═CO2↑+H2O |
| B、往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
| C、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
| D、澄清石灰水与过量小苏打溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6 mol/L |
| B、1.4 mol/L |
| C、3.2 mol/L |
| D、1.8 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com