
| A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C、可通过溶液导电能力的大小判断强弱电解质 |
| D、在NaHSO4溶液中存在的离子有:Na+、H+、HSO4-、OH- |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、OH-、NO3-、Cl- |
| B、Ca2+、H+、Cl-、HCO3- |
| C、Mg2+、Al3+、Cl-、SO42- |
| D、Na+、Ca2+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2 (SO4)3=2Al3++3SO42- |
| B、Ba(OH)2=Ba2++2OH- |
| C、Na2SO4=Na2++SO42- |
| D、NH4NO3=NH4++NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸、纯碱、硝酸钠 |
| B、醋酸、烧碱、明矾[KAl(SO4)2?12H2O] |
| C、硝酸、乙醇、高锰酸钾 |
| D、盐酸、熟石灰、苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
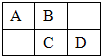 A、B、C、D为短周期元素,在周期表中所处的位置如图所示.A、D两元素的原子核外电子数之和等于B、C两元素的原子核外电子数之和.C元素的质子数是B元素的质子数的2倍.
A、B、C、D为短周期元素,在周期表中所处的位置如图所示.A、D两元素的原子核外电子数之和等于B、C两元素的原子核外电子数之和.C元素的质子数是B元素的质子数的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:
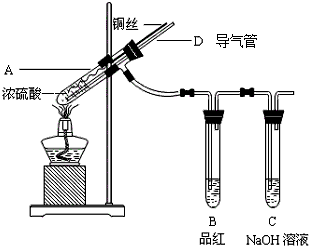 某同学为了探究铜与浓硫酸的反应,进行了如下实验.
某同学为了探究铜与浓硫酸的反应,进行了如下实验.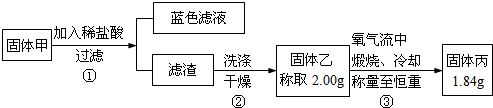
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com