
 (1)①氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的.若电解质溶液为H2SO4,其正极电极反应式:
(1)①氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的.若电解质溶液为H2SO4,其正极电极反应式:| 13 |
| 2 |
| 5800g |
| 58g/mol |
| 12.8g |
| 64g/mol |
| n |
| V |
| 5800g |
| 58g/mol |
| 13 |
| 2 |
| 13 |
| 2 |
| 13 |
| 2 |
| 13 |
| 2 |
| 12.8g |
| 64g/mol |
| 0.4mol |
| 2 |
| ||
| ||
| 0.4mol×2mol |
| 2mol×0.4mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
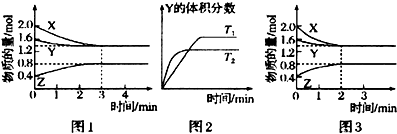
| A、容器中发生的反应可表示为:4X(g)+Y(g)═2Z(g) |
| B、反应进行的前3min内,用x表示的反应速率V(X)=0.3mol/(L?min) |
| C、升高温度,反应的化学平衡常数K增大 |
| D、若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、次磷酸的电离方程式为H3PO2?3H++PO23- |
| B、次磷酸中P的化合价为+1 |
| C、NaH2PO2是酸式盐 |
| D、NaH2PO2溶液显弱酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
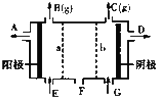 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )| A、从A口出来的是H2SO4溶液 |
| B、阳极反应式为2H++2e-═H2↑ |
| C、a是阳离子交换膜,允许H+通过 |
| D、Na2SO4溶液从E口加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液是电中性的,胶体是带电的 |
| B、可以用渗析的方法将胶体与溶液分离 |
| C、胶体中的分散质粒子大小在1~10nm之间 |
| D、向煮沸的稀氢氧化钠溶液中滴加饱和和FeC13溶液配制Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的甲、乙、丙三种晶体,试写出:
如图所示的甲、乙、丙三种晶体,试写出:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
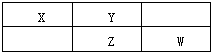 X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com