
| A、溶液是电中性的,胶体是带电的 |
| B、可以用渗析的方法将胶体与溶液分离 |
| C、胶体中的分散质粒子大小在1~10nm之间 |
| D、向煮沸的稀氢氧化钠溶液中滴加饱和和FeC13溶液配制Fe(OH)3胶体 |


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:
| A、1 mol氯气参加氧化还原反应,转移的电子数一定为2NA |
| B、标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA |
| C、含1 mol FeCl3的溶液中Fe3+的个数为NA |
| D、1.8 g NH4+中含有的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成的SO2气体为0.3mol |
| B、生成的SO2气体为1.5mol |
| C、生成的H2气体为1.2mol |
| D、生成的BaSO4沉淀361.15g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中Se是氧化产物,I2是还原产物 |
| B、反应②中浓硫酸体现了氧化性和酸性 |
| C、SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是SeO2>H2SO4(浓)>I2 |
| D、反应①中每有0.6molI2生成,转移电子数目为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将样品溶于蒸馏水,加入过量NaOH过滤后,加盐酸蒸发 |
| B、将样品溶于蒸馏水,加入过量 Na2CO3过滤后,加盐酸蒸发 |
| C、将样品溶于蒸馏水,加入过量Ca(OH)2过滤,然后加过量Na2CO3过滤,在滤液中加过量盐酸后蒸发 |
| D、用半透膜有选择地除去Ca2+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)①氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的.若电解质溶液为H2SO4,其正极电极反应式:
(1)①氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的.若电解质溶液为H2SO4,其正极电极反应式:| 13 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
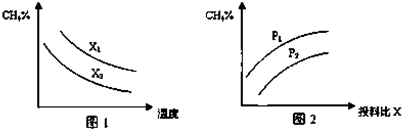
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
n- 3 |
n- 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com