
【题目】乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室用CH3COOH (60g/mol)和CH3CH2CH2CH2OH(74g/mol)在浓硫酸加热条件下制备乙酸正丁酯(116g/mol)。
主要实验步骤如下:


Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.25g,0.125mol)正丁醇、7.2mL(12.0g,0.2mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离与提纯:
①将烧瓶中反应后的混后物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水,10mL10%碳酸钠溶液洗至无酸性(pH=7),充分振荡后静置,分去水层
②将酯层倒入小锥形瓶中,加少量无水硫酸镁
③过滤,将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.主要试剂及产物的物理常数如下:

根据以上信息回答下列问题:
(1)制备乙酸正丁酯的化学方程式为:__________________________________ ,制备过程中易生成副产物正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3),该副反应的化学方程式为:___________。
(2)图1整个装置可看作由分水器、圆底烧瓶和______(填仪器名称)组成,其中冷水应从______(填a或b)管口通入.分水器可将生成的水从反应体系中分离出来,有利于______,如何判断该合成反应达到了终点:_____________________。
(3)在操作步骤①时,用右手压住分液漏斗的玻璃塞,左手握住旋塞将分液漏斗倒转过来,用力振荡,振摇几次后要放气,放气时支管口不能对着人和火.在操作步骤②加入无水硫酸镁的作用是________ 。
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在______中加热比较合适(双选)。
A.水B.甘油(沸点290℃) C.砂子D.石蜡油(沸点200~300℃)
如果蒸馏装置如图2所示,则收集到的产品中可能混有______杂质。
(5)反应结束后,生成11.6g乙酸正丁酯,则正丁醇的转化率约为______。
【答案】CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O 2CH3CH2CH2CH2OH
CH3COOCH2CH2CH2CH3+H2O 2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O (球形)冷凝管 b 反应向正向进行,提高反应物转化率 分水器中水面不再升高 干燥 BD 正丁醚 80%
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O (球形)冷凝管 b 反应向正向进行,提高反应物转化率 分水器中水面不再升高 干燥 BD 正丁醚 80%
【解析】
(1)乙酸和正丁醇在浓硫酸作用下发生酯化反应生成乙酸正丁酯和水;正丁醇之间发生反应生成正丁醚和水;
(2)由装置图可知,装置由分水器、圆底烧瓶和冷凝管组成;冷凝时,应尽量使冷凝水充满冷凝管,以充分冷凝;酯化反应为可逆反应,分离出生成物有利于平衡正向移动,当反应物、生成物的浓度、物质的量等不再改变时达到平衡状态;
(3)产品有水考虑干燥;
(4)乙酸正丁酯的沸点为126.1℃,选择沸点稍高的液体加热;正丁醇和乙酸易溶于水,在用水洗、10%碳酸钠溶液洗时,已经被除去,则乙酸正丁酯的杂质为正丁醚;
(5)产率=![]() 计算得到。
计算得到。
(1)乙酸与正丁醇反应生成乙酸正丁酯和水,其反应方程式:CH3COOH+HO(CH2)3CH3 ![]() CH3COO(CH2)3CH3+H2O,正丁醇之间发生反应生成正丁醚和水,反应方程式为:2CH3CH2CH2CH2OH
CH3COO(CH2)3CH3+H2O,正丁醇之间发生反应生成正丁醚和水,反应方程式为:2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O;
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O;
故答案为:CH3COOH+HO(CH2)3CH3 ![]() CH3COO(CH2)3CH3+H2O;2CH3CH2CH2CH2OH
CH3COO(CH2)3CH3+H2O;2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O;
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O;
(2)由装置图可知,装置由分水器、圆底烧瓶和冷凝管组成;冷凝管中的冷凝水应该从下口进上口出,所以从b管口通入;酯化反应为可逆反应,分离出生成物有利于平衡正向移动,当反应物、生成物的浓度、物质的量等不再改变时达到平衡状态,则分水器中的水层不再增加时,视为反应的终点;
故答案为:冷凝管;b;反应向正向进行,提高反应物转化率;分水器中水面不再升高;
(3)反应生成的酯有水分,所以要用无水硫酸镁干燥;
故答案为:干燥;
(4)乙酸正丁酯的沸点为126.1℃,选择沸点稍高的液体加热,所以可以在甘油和石蜡油中加热,水的沸点为100℃,加热温度太低,用砂子加热温度太高不易控制;正丁醇和乙酸易溶于水,在用水洗、10%碳酸钠溶液洗时,已经被除去,正丁醚与乙酸丁酯互溶,水洗和10%碳酸钠溶液洗时不能除去,所以蒸馏时会有少量挥发进入乙酸丁酯,则乙酸正丁酯的杂质为正丁醚;
故答案为:BD;正丁醚;
(5)CH3COOH+HO(CH2)3CH3 ![]() CH3COO(CH2)3CH3+H2O,则理论上应生成酯为0.125mol,实际生成11.6g,所以乙酸正丁酯的产率为
CH3COO(CH2)3CH3+H2O,则理论上应生成酯为0.125mol,实际生成11.6g,所以乙酸正丁酯的产率为![]() =80%,
=80%,
故答案为:80%。


科目:高中化学 来源: 题型:
【题目】实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同学设计下列实验以确定混合气体中含有乙烯和SO2。
(1)(I)、(Ⅱ)、(Ⅲ)、(Ⅳ)中盛放的试剂分别是________(可重复使用,填字母)。
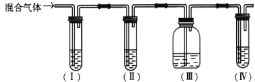
A.品红溶液 B. NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是_________________。
(3)使用装置Ⅱ的目的是_________________。
(4)使用装置Ⅲ的目的是_________________。
(5)确定含有乙烯的现象是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表的一部分、表中阿拉伯数字(1、2……)是元素周期表中行或列的序号,请参照元素A~I在表中的位置,回答下列问题。
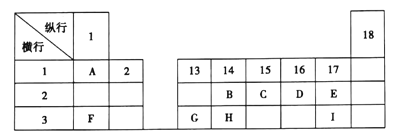
(1)B、C、H三元素中非金属性最强的是__________(写出元素符号)。
(2)表中某元素能形成两性氧化物,写出该氧化物的化学式___________。
(3)D与F构成原子个数比为1:1和1:2的两种离子化合物Z和M,写出Z与H2O反应的化学方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
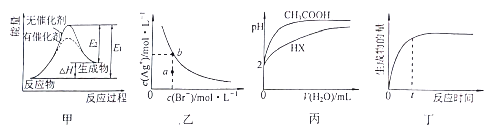
A. 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化
B. 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液
C. 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH
D. 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
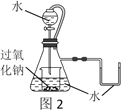
【题目】如图1是钠及其化合物与水反应关系图,两圆圈相交的部分表示圆圈内的物质相互发生的反应。请按要求填空。
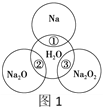
(1)反应①的化学方程式_____________。
(2)在反应②中的混合液滴入酚酞,可观察到的现象是____________。
(3)研究性学习小组设计图2装置探究反应③是放热反应。
i.向烧杯内滴加水时,可观察到的现象是____________。
ⅱ.该反应的化学方程式为____________。
ⅲ.举例过氧化钠的用途______。(写一种)
(4)超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,写出该反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.
(1)实验室可将氧气通过高压放电管来制取臭氧:3O2![]() 2O3。将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,求其中臭氧的体积。______________
2O3。将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,求其中臭氧的体积。______________
(2)加热条件下,O3、O2都能与铜粉反应,实验室中将氧气和臭氧的混合气体0.896L(标准状况)通入盛有足量铜粉加热充分反应,混合气体被完全吸收,粉末的质量变为1.6g。求原混合气中臭氧的体积分数为______。(已知:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是

A. 按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B. 图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C. 铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D. 图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置图及有关说法正确的是( )

A. 装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大
B. 装置①中K键闭合时,片刻后可观察到滤纸a点变红色
C. 装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开
D. 装置③中当铁制品上析出1.6![]() 铜时,电源负极输出的电子数为0.025NA
铜时,电源负极输出的电子数为0.025NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃经催化加氢后得到2-甲基丁烷,该烃可能是
A. 3-甲基-1-丁烯B. 2-甲基丙烷
C. 2-甲基-1-丁烯D. 3,3-二甲基-1-丁烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com