
【题目】如图1是钠及其化合物与水反应关系图,两圆圈相交的部分表示圆圈内的物质相互发生的反应。请按要求填空。
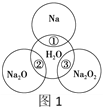
(1)反应①的化学方程式_____________。
(2)在反应②中的混合液滴入酚酞,可观察到的现象是____________。
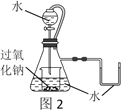
(3)研究性学习小组设计图2装置探究反应③是放热反应。
i.向烧杯内滴加水时,可观察到的现象是____________。
ⅱ.该反应的化学方程式为____________。
ⅲ.举例过氧化钠的用途______。(写一种)
(4)超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,写出该反应的化学方程式____________。
【答案】2Na+2H2O=2NaOH+H2↑ 混合液变红 烧杯中产生气泡,反应放热,锥形瓶内气体体积增大 2Na2O2+2H2O=4NaOH+O2↑ 供氧剂(或漂白剂) 4KO2+2CO2=2K2CO3+3O2
【解析】
(1)反应①是钠与水反应生成氢氧化钠和氢气;
(2)在反应②是氧化钠与水反应生成氢氧化钠,在混合液中滴入酚酞,酚酞遇碱变红;
(3)反应③过氧化钠与水反应生成氢氧化钠和氧气,是放热反应,图2装置中:i.向烧杯内滴加水时,反应产生氧气,故烧杯中产生气泡,反应放热,锥形瓶内气体体积增大,U形管内液体右移,静止后液面左边低于右边;ⅱ.该反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;ⅲ.过氧化钠的用途有供氧剂、漂白剂等等;
(4)超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,发生反应的化学方程式为:4KO2+2CO2=2K2CO3+3O2。
(1)反应①是钠与水反应生成氢氧化钠和氢气,其化学方程式为:2Na+2H2O=2NaOH+H2↑;
(2)在反应②是氧化钠与水反应生成氢氧化钠,在混合液中滴入酚酞,酚酞遇碱变红,则可观察到的现象是:混合液变红;
(3)反应③过氧化钠与水反应生成氢氧化钠和氧气,是放热反应,图2装置中:i.向烧杯内滴加水时,反应产生氧气,故烧杯中产生气泡,反应放热,锥形瓶内气体体积增大,U形管内液体右移,静止后液面左边低于右边;ⅱ.该反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;ⅲ.过氧化钠的用途有供氧剂、漂白剂等等;
(4)超氧化钾(KO2)与过氧化钠一样能吸收CO2生成碳酸盐及O2,发生反应的化学方程式为:4KO2+2CO2=2K2CO3+3O2。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①CO(NH2)2(s)+H2O(1)2HN3(g)+CO2(g)ΔH=+133.6kJ/mol。关于该反应的下列说法正确的是____________(填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度可使尿素的转化率增大
d.达到平衡后,缩小容器的体积,平衡向逆反应方向移动,达到平衡时NH3的浓度大于原平衡
②尿素在一定条件下可将氮的氧化物还原为氮气。
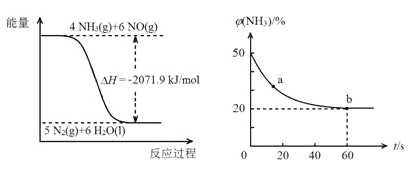
已知:
再结合①中的信息,则反应2CO(NH2)2(s)+6NO(g)5N2(g)+2CO2(g)+4H2O(1)的ΔH=______kJ/mol。
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下应生成尿素:CO2(g)+2NH3(g)CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为____________
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2,已知9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使溶液中的C元素全部以CO2形式逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>_________________________。
(3)用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH的浓度来制备纳米Cu2O,装置如图所示:
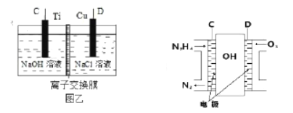
上述装置中阳极反应式为_________________________,该电解池中的离子交换膜为______________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色固体粉末,已知除了含有 KNO3 以外,其中可能还含有 KCl、Ba(NO3)2、CuSO4、K2CO3、Na2SO4 中的一种或几种,现通过以下实验来确定该样品的组成:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量 AgNO3 溶液,产生白色沉淀; 根据上述实验事实,回答下列问题:
(1)原白色粉末中除 KNO3 以外一定还含有的物质是_________,一定不含有的物质 是_____,可能存在的物质是_____(填化学式);
(2)请写出第②步变化中所涉及的化学反应方程式:_____;
(3)A 同学为了确认该固体粉末中“可能存在的物质”是否存在, 他重新取了少量该样品于试管中加适量的蒸馏水溶解,请根据该同学设计的方案填空:
![]()
加入的试剂①_________试剂②_____(填化学式);当加入试剂②时,实验现 象为_____就可以确认该物质一定存在。
(4)B 同学为了进一步确定该样品的成份,他称取了 10.0 g 该固体,按如下方案进行实验: 说明:实验中产生的气体已经换算成标准状况下的体积。
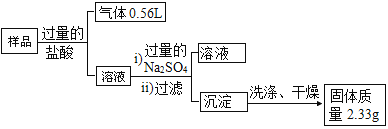
①请简述在实验室进行上述实验过程时如何洗涤沉淀_____。
②若按照 B 同学以上实验方案,还需对“溶液 2”中的溶质进一步分析,通过已有的实验数据分析,若该 样品中含 KNO3 的质量分数为_____时,可以确认样品中一定不含有“可能存在的物质”。
查看答案和解析>>
科目:高中化学 来源: 题型:
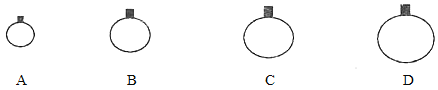
【题目】(1)常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为SO2的是_____(填选项序号)。
(2)在标准状况下,2.24L由N2、N2O组成的混合气体中含有的氮元素的质量约为_______。
(3)在0.1L由KCl、K2SO4、ZnSO4形成的植物营养液中,c(K+)=0.7 mol·L1,c(Zn2+)=0.1 mol·L1,
c(Cl)=0.3mol·L1,向混合溶液中滴加足量的BaCl2溶液后产生沉淀的物质的量为_______。
(4)氯气(Cl2)、重铬酸钾(K2Cr2O7)是常用的氧化剂。
①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯气对鱼的危害。已知25.0mL0.100 mol·L1 Na2S2O3溶液恰好把标准状况下224mL的Cl2完全转化为Cl,则S2O32将转化成______。
A S2 B S C SO32 D SO42
②实验室可用K2Cr2O7固体与浓盐酸反应制备氯气,发生反应化学方程式为K2Cr2O7 + 14HCl(浓)=3Cl2↑ + 2CrCl3 +2KCl +7H2O,若反应中转移0.6mole,则被氧化HCl的物质的量为_______。
(5)在干燥烧瓶中用向下排空气法收集氨气,由于空气不可能排净(已知:空气的平均相对分子质量为29),所以瓶内气体对氢气的相对密度为9.5,将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积的_______。
(6)100mL 0.3mol/L Na2SO4(密度为d1 g/cm3)和50mL 0.2mol/L Al2(SO4)3(密度为d2 g/cm3)混合,所得密度为d3 g/cm3的混合溶液中SO42-的浓度为___________。(用含d1,d2, d3的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室用CH3COOH (60g/mol)和CH3CH2CH2CH2OH(74g/mol)在浓硫酸加热条件下制备乙酸正丁酯(116g/mol)。
主要实验步骤如下:


Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.25g,0.125mol)正丁醇、7.2mL(12.0g,0.2mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离与提纯:
①将烧瓶中反应后的混后物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水,10mL10%碳酸钠溶液洗至无酸性(pH=7),充分振荡后静置,分去水层
②将酯层倒入小锥形瓶中,加少量无水硫酸镁
③过滤,将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.主要试剂及产物的物理常数如下:

根据以上信息回答下列问题:
(1)制备乙酸正丁酯的化学方程式为:__________________________________ ,制备过程中易生成副产物正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3),该副反应的化学方程式为:___________。
(2)图1整个装置可看作由分水器、圆底烧瓶和______(填仪器名称)组成,其中冷水应从______(填a或b)管口通入.分水器可将生成的水从反应体系中分离出来,有利于______,如何判断该合成反应达到了终点:_____________________。
(3)在操作步骤①时,用右手压住分液漏斗的玻璃塞,左手握住旋塞将分液漏斗倒转过来,用力振荡,振摇几次后要放气,放气时支管口不能对着人和火.在操作步骤②加入无水硫酸镁的作用是________ 。
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在______中加热比较合适(双选)。
A.水B.甘油(沸点290℃) C.砂子D.石蜡油(沸点200~300℃)
如果蒸馏装置如图2所示,则收集到的产品中可能混有______杂质。
(5)反应结束后,生成11.6g乙酸正丁酯,则正丁醇的转化率约为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制饱和氯水成份的实验中,下列根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向淀粉碘化钾溶液中滴加少量氯水,溶液变蓝,说明氯水中含有ClO-
D.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是制取无水氯化铜的实验装置图,在A装置中将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中,烧瓶中发生反应的原理为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
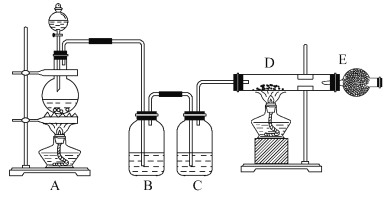
请回答下列问题:
(1)装置中盛放浓盐酸的仪器名称为_______。
(2)B瓶中试剂的作用是除去氯气中含有的氯化氢气体,C瓶中试剂的作用是______。
(3)玻璃管D中的反应方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是___________________。
(2)Ⅰ中,生成K2MnO4的化学方程式是______________________________。
(3)Ⅱ中,浸取时用稀KOH溶液的原因是_________________。
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是_____________________。
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4,装置如图:

①b极是______极(填“阳”或“阴”),D是_______________。
②结合电极反应式简述生成KMnO4的原理:_______________________________。
③传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,其原因是______。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4+H2SO4=H2C2O4+Na2SO4,5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,摩尔质量:Na2C2O4134gmol-1、KMnO4158gmol-1。
ⅰ.称取ag产品,配成50mL溶液。
ⅱ.称取bgNa2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液VmL(杂质不参与反应)。
滴定终点的现象为_______________,产品中KMnO4的质量分数的表达式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com