
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)
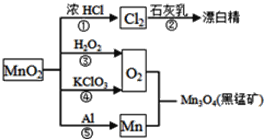
A. 反应⑤说明该条件下铝的还原性强于锰
B. 反应①②③④⑤均属于氧化反应和离子反应
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D. 反应①中氧化剂与还原剂的物质的量之比为1∶4
【答案】A
【解析】
根据氧化还原反应和离子反应的本质和规律进行分析。
A.反应⑤是置换反应,铝是还原剂,锰是还原产物,所以铝的还原性强于锰,故A正确;
B.①②③④⑤五个反应中都有元素的化合价发生了变化,所以都是氧化还原反应。反应④⑤不是在水溶液中发生的反应,所以不是离子反应,故B错误;
C.反应③中氧元素的化合价是从-1升高到0,而反应④中氧元素的化合价是从-2升高到0,所以两者转移的电子数之比为1∶2,故C错误;
D.反应①的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,参加反应的HCl中有一半被氧化,所以氧化剂和还原剂之比为1∶2,故D错误。
MnCl2+Cl2↑+2H2O,参加反应的HCl中有一半被氧化,所以氧化剂和还原剂之比为1∶2,故D错误。
正确答案:A。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.二氧化硅溶于水显酸性B.二氧化碳通入Na2SiO3溶液中可以得到硅酸
C.二氧化硅常用作干燥剂D.二氧化硅是酸性氧化物,它不溶于任何酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素a、b、c、d、e为前20号主族元素,原子序数依次增大。b元素原子最外层电子数与核外电子总数之比为2:3;c的氢化物能与其最高价氧化物对应的水化物反应生成一种盐;a与b、c均可以形成电子总数为10的分子;d元素的氧化物能使品红溶液褪色,且加热后品红颜色复原;e原子是前20号主族元素中原子半径最大的。请回答:
(1)bd2的电子式_________;e的最高价氧化物的水化物所含化学键类型为_______、________
(2)在只由a、b两种元素组成的化合物中,如果化合物的质量相同,在氧气中完全燃烧时消耗氧气最多的是________;
(3)d的最高价氧化物对应的水化物是铅蓄电池的电解质溶液。正极板上覆盖有二氧化铅,负极板上覆盖有铅,① 写出放电时负极的电极反应式:______________________________;
② 铅蓄电池放电时,溶液的pH将_________(填增大、减小或不变)。当外电路上有0.5mol电子通过时,溶液中消耗电解质的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】社会在飞速发展,环境问题也备受关注,如何减少污染,寻求清洁能源是现代学者研究的方向。
Ⅰ、为了模拟汽车尾气在催化转化器内的工作情况
(1)控制条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
前2s内的平均反应速率v(N2)=_______
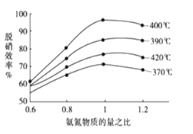
(2)用氨气催化氧化还原法脱硝(NOx)
①根据下图 (纵坐标是脱硝效率、横坐标为氨氮物质的量之比),判断提高脱硝效率的最佳条件是:___。
②已知: N2(g)+O2(g)=2NO(g)△H=+akJ/mol
N2(g)+3H2(g) ![]() 2NH3(g)△H=-bk/mol
2NH3(g)△H=-bk/mol
2H2(g)+O2(g)=2H2O(g)△H=-ckJ/mol其中a、b、c均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g) ![]() 4N2(g)+6H2O(g)△H=________。
4N2(g)+6H2O(g)△H=________。
Ⅱ、甲醇是一种很好的燃料
(1)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)CH3OH(l) △H<0 。为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
① | 180 | 2:3 | 0.1 |
② | n | 2:3 | 5 |
③ | 350 | m | 5 |
表中剩余的实验数据:n=________,m=________.
(2)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。下列说法正确的是______________(填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4 g CH3OH转移1.2 mol电子
④负极反应式为CH3OH+8OH--6e-=CO32-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关分散系的叙述中不正确的是( )
A.胶体分散质微粒直径较大,不能透过滤纸
B.液态分散系根据分散质粒子大小分为溶液、胶体和浊液三类
C.利用丁达尔效应可以区分溶液和胶体
D.纳米材料分散到液体分散剂中得到的分散系属于胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李克强总理在《2018年国务院政府工作报告》中强调“今年二氧化硫、氮氧化物排放量要下降3%。”因此,研究烟气的脱硝(除NOx)、脱硫(除SO2)技术有着积极的环保意义。
(1)汽车的排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。

①图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是___________。(填“a”或“b”)
②T℃时,该反应的化学平衡常数K=_______________;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_________移动。(填“向左”、“向右”或“不”)
③15min时,若改变外界反应条件,导致n (NO)发生图中所示变化,则改变的条件可能是_______________________________________________ (任答一条即可)。
(2)在催化剂作用下,用还原剂[如肼(N2H4)]选择性地与NOx反应生成N2和H2O。
已知200℃时:Ⅰ.3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1;
II. N2H4(g)+H2(g) =2NH3(g) ΔH2=-41.8 kJ·mol-1。
①写出肼的电子式:____________________。
②200℃时,肼分解成氮气和氢气的热化学方程式为:_____________________________。
③目前,科学家正在研究一种以乙烯作为还原剂的脱硝原理,其脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如下图所示。

为达到最佳脱硝效果,应采取的条件是_________________________________________。
(3)利用电解装置也可进行烟气处理,如图可将雾霾中的NO、SO2分别转化为NH4+和SO42-,阳极的电极反应式为____________________________;物质A是______________ (填化学式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是我国规定的食盐补碘剂,利用“KClO3氧化法”可制备KIO3,流程如下:
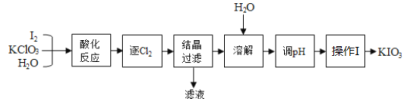
已知:“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。
(1)KIO3所含的化学键有______________________。
(2)逐出的Cl2可用_________________检验;“滤液”中的溶质主要是____________;“调pH”中所用的试剂是_________________。
(3)已知KIO3在水中的溶解度随温度升高而增大,则操作I包含的操作应该是_______、_______、过滤。
(4)为测定“加碘食盐”中碘元素含量:①称取50.000g食盐,配成250mL溶液;②量取25.00mL溶液于锥形瓶中,加入足量KI,并用少量稀硫酸酸化,使KIO3与KI反应完全;③以淀粉为指示剂,用2.0×10-4mol/L的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液体积为30.00mL。已知:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),2Na2S2O3+I2→Na2S4O6+2NaI。测定过程中,所需仪器在使用前必须检查是否漏液的有________________。
(5)判断滴定终点的依据是________________________________。
(6)配平:KIO3+KI+H2SO4→K2SO4+I2+H2O ____________
(7)该食盐中碘元素的含量是_________mg/kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com