
【题目】用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如下图所示的催化剂循环实现。

(1)上述转化中属于氧化还原反应的是________(填序号)。
(2)反应②中O2与CuCl2的物质的量之比是_________。
(3)一定条件下,以HCl、CuO、O2为原料,写出该转化的总反应方程式______________。
【答案】 ② 1:2 4HCl+O2 2H2O+2Cl2
2H2O+2Cl2
【解析】根据图示可知:反应①2HCl+CuO=CuCl2+H2O和反应②2CuCl2+O2=2CuO+2Cl2;反应①为非氧化还原反应,反应②为氧化还原反应;根据反应②可知O2与CuCl2的物质的量之比;把反应①和②消去CuO和CuCl2,即可得到以HCl、CuO、O2为原料的总反应方程式;据此分析解答。
(1)根据反应①2HCl+CuO=CuCl2+H2O,各元素化合价不变,为非氧化还原反应,②2CuCl2+O2=2CuO+2Cl2可知,氧元素、氯元素化合价发生了变化,为氧化还原反应;正确答案:②。
(2)根据2CuCl2+O2=2CuO+2Cl2可知,O2与CuCl2的物质的量之比为1:2;正确答案:1:2。
(3)根据反应①2HCl+CuO=CuCl2+H2O 和②2CuCl2+O2=2CuO+2Cl2,反应①×2+反应②,整理可得该转化的总反应方程式. 4HCl+O2 2H2O+2Cl2;正确答案:4HCl+O2
2H2O+2Cl2;正确答案:4HCl+O2 2H2O+2Cl2。
2H2O+2Cl2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲醇燃料电池被认为是21世纪电动汽车候选动力源
(1)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1=+49.0kJmol﹣1
②CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2(g)△H2
O2(g)═CO2(g)+2H2(g)△H2
已知H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8kJmol﹣1 , 则反应②的△H2= .
O2(g)═H2O(g)△H=﹣241.8kJmol﹣1 , 则反应②的△H2= .
(2)工业上一般可采用如图1所示反应来合成甲醇:CO(g)+2H2(g)CH3OH(g),现实验室模拟该反应并进行分析,图1是该反应在不同温度下CO的转化率随时间变化的曲线
①该反应的焓变△H0(填“>”“<”或“=”).
②T1和T2温度下的平衡常数大小关系是K1K2(填“>”“<”或“=”)
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2 , 测得CO 和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,CO的平均反应速率v(CO)= , 该反应的平衡常数为K=![]()
④恒容条件下,达到平衡后,下列措施中能使 ![]() 增大的有
增大的有
A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 过量氨水滴入氯化铝溶液中:Al3++3OH―![]() Al(OH)3 ↓
Al(OH)3 ↓
B. 硫代硫酸钠溶液与稀硫酸混合:S2O32—+2H+![]() S↓+SO2↑+H2O
S↓+SO2↑+H2O
C. NaClO溶液与FeCl2溶液混合:2ClO―+Fe2++2H2O![]() 2HClO + Fe(OH)2 ↓
2HClO + Fe(OH)2 ↓
D. 次氯酸钙溶液中通入过量CO2 :Ca2+ +2ClO― +H2O +CO2 ![]() CaCO3↓+2HClO
CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,连二亚硫酸钠又称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如下:

请回答下列问题:
(1)保存连二亚硫酸钠的注意事项_____________________(任写一项)。
(2)向液锌中鼓入M气体,使液态锌雾化,目的是___________________;鼓入的气体M为空气的一种主要成分,则M的电子式为________________;
(3)流程②的化学方程式为________________________________________________。
(4)流程③的分离方法步骤为过滤、洗涤、干燥。其中过滤用到的玻璃仪器除烧杯、玻璃棒外还有________;洗涤所用试剂是_______;实验时加入NaCl固体的作用是____________________________。
(5)连二亚硫酸钠可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),写出该反应的离子方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3mol O2加入到V L的反应器中,在高温下放电,经t1s建立了平衡体系:3O22O3 , 此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是( )
A.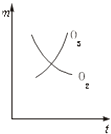
B.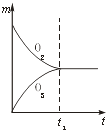
C.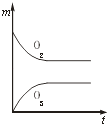
D.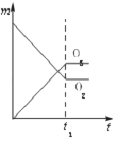
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 |
|
从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是 。
(2)C中白色沉淀是 ,该沉淀的生成表明SO2具有 性。
(3)C中液面上方生成浅棕色气体的化学方程式是 。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是 ;
乙在A、B间增加洗气瓶D,D中盛放的试剂是 。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因: 。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。如图是一种微生物燃料电池的工作原理示意图,下列有关说法不正确的是

A. B电极是正极
B. 电池内H+从左侧向右侧迁移
C. A电极的电极反应式: CH3COOH + 8e-+ 2H2O=2CO2 +8H+
D. 该电池可利用有机废水等有机废弃物作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.药片变色、潮解,则不宜服用
B.复方氢氧化铝片常用来治疗胃酸过多症
C.“是药三分毒”,因此,有病不要服药
D.实行“食盐加碘”是控制碘缺乏症的有效途径之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:

下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com