
【题目】![]() 时,
时,![]() 的
的![]() ,
,![]() ,室温下向10mL
,室温下向10mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象
溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象![]() 因有逸出未画出
因有逸出未画出![]() 。下列说法错误的是
。下列说法错误的是
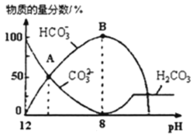
A.A点所示溶液的![]()
B.B点所示溶液:![]()
C.A点![]() 点发生反应的离子方程式为
点发生反应的离子方程式为![]()
D.分步加入酚酞和甲基橙,用滴定法可测定![]() 与
与![]() 混合物的组成
混合物的组成
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在一个容积为1L的密闭容器中,充入1molH2(g)和1mol I2(g),发生反应H2(g)+I2(g)![]() 2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g),则下列判断正确的是( )
I2(g),则下列判断正确的是( )
A.后一反应的平衡常数为1
B.后一反应的平衡常数为0.5
C.后一反应达到平衡时,H2的平衡浓度为0.25 mol·L-1
D.后一反应达到平衡时,HI(g)的平衡浓度0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
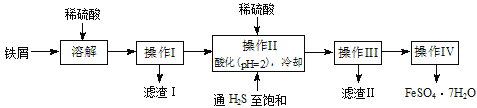
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是__________________________。
(2)操作II中,通入硫化氢至饱和的目的是_________________________________;在溶液中用硫酸酸化至pH=2的目的是___________________________________________。
(3)操作IV的顺序依次为:_________________、冷却结晶、__________________。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②________________________________________________________。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为:___________________。
②判断此滴定实验达到终点的方法是_______________________________________。
③计算上述样品中FeSO4·7H2O的质量分数为_________(用小数表示,保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图分析,下列说法正确的是( )
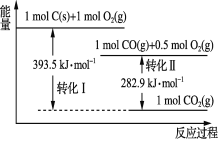
A.1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B.反应2CO(g)+O2(g)=2CO2(g)中,反应物的总键能小于生成物的总键能
C.C→CO的热化学方程式为2C(s)+O2(g)=2CO(g) ΔH=-110.6 kJ·mol-1
D.热值是指一定条件下单位质量的物质完全燃烧所放出的热量,则CO的热值为282.9 kJ·g-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的某反应化学方程式为X +Y→M+N +H2O(未配平,反应条件已略去),下列叙述错误的是
A. 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3- = Fe3+ +NO↑+2H2O
D. 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是
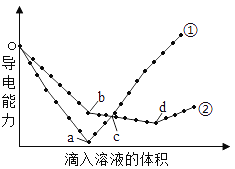
A.b→d反应的离子方程式为:H++OH-=H2O
B.o→a反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.c点导电能力相同,所以两溶液中含有相同量的OH–
D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 2.00 | 0.00 |
1 | 0.90 | 1.80 | 0.20 |
3 | 0.75 | 1.50 | 0.50 |
5 | 0.65 | 1.30 | 0.70 |
9 | 0.55 | 1.10 | 0.90 |
10 | 0.55 | 1.10 | 0.90 |
14 | 0.55 | 1.10 | 0.90 |
(1)体系中发生反应的化学方程式____________;
(2)列式计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3)该反应达到平衡时反应物X的转化率α等于________;
(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1____________,2______________,3______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.在醋酸溶液的![]() ,将此溶液稀释1倍后,溶液的
,将此溶液稀释1倍后,溶液的![]() ,则
,则![]()
B.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
C.![]() 盐酸的
盐酸的![]() ,
,![]() 盐酸的
盐酸的![]()
D.若1mL![]() 的盐酸与100mL
的盐酸与100mL![]() 溶液混合后,溶液的
溶液混合后,溶液的![]() 则
则![]() 溶液的
溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷电路板(PCB)是用腐蚀液(FeCl3溶液)将覆铜板上的部分铜腐蚀掉而制得。一种制作PCB并将腐蚀后废液(其中金属阳离子主要含Fe3+、Cu2+、Fe2+)回收再生的流程如图。
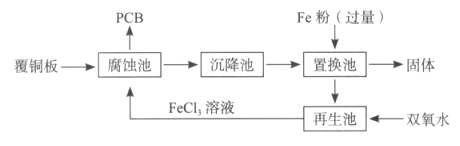
请回答:
(1)腐蚀池中发生反应的化学方程式是__。
(2)上述各池中,没有发生化学变化的是__池。
(3)由置换池中得到固体的操作名称是__。
(4)置换池中发生反应的离子方程式有__。
(5)请提出利用酸从固体中回收Cu并将滤液回收利用的合理方案:__。
(6)向再生池中通入Cl2也可以使废液再生,相比Cl2,用双氧水的优点是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com