
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
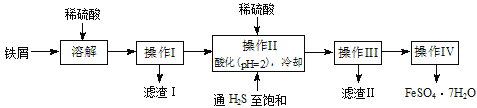
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是__________________________。
(2)操作II中,通入硫化氢至饱和的目的是_________________________________;在溶液中用硫酸酸化至pH=2的目的是___________________________________________。
(3)操作IV的顺序依次为:_________________、冷却结晶、__________________。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②________________________________________________________。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为:___________________。
②判断此滴定实验达到终点的方法是_______________________________________。
③计算上述样品中FeSO4·7H2O的质量分数为_________(用小数表示,保留三位小数)。
【答案】取少量晶体溶于水,滴加KSCN溶液,溶液不呈现红色,表明溶液不含Fe3+ 除去溶液中的Sn2+,并防止Fe2+被氧化 防止Fe2+生成沉淀 蒸发浓缩 过滤、洗涤、干燥 降低洗涤过程中FeSO4·7H2O的损耗 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 滴入最后一滴KMnO4溶液时,溶液变为浅红色且半分钟内不褪色 0.975
【解析】
含少量锡、氧化铁等杂质的铁屑用稀硫酸溶解,得到含Fe2+和Sn2+的溶液,不溶性的杂质过滤除去,滤液里通入H2S,使Sn2+形成SnS沉淀,控制溶液的PH=2,保证Fe2+不沉淀,过滤后把含有FeSO4的滤液蒸发浓缩、冷却结晶,即可过滤得到FeSO4·7H2O。
(1)Fe3+的检验可以用KSCN溶液,即取少量晶体溶于水,滴加KSCN溶液,溶液不呈现红色,表明溶液不含Fe3+。
(2)操作II中,通入硫化氢,使Sn2+形成SnS沉淀,同时由于Fe2+具有还原性,容易被氧化,而H2S可以保护Fe2+不被氧化。由于SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,所以在溶液中用硫酸酸化至pH=2。故答案为:除去溶液中的Sn2+,并防止Fe2+被氧化;防止Fe2+生成沉淀。
(3)从溶液中获得带结晶水的晶体,为了防止加热失去结晶水,所以需要将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩,过滤、洗涤、干燥。
(4)操作IV得到的绿矾晶体上附着有硫酸等杂质,需要洗涤,而绿矾溶于水,但在冰水中溶解度比较小,所以用冰水洗涤,故答案为降低洗涤过程中FeSO4·7H2O的损耗。
(5)①KMnO4和Fe2+发生氧化还原反应,离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 。
②KMnO4溶液是紫红色的,当溶液中的Fe2+耗尽时,再滴入KMnO4溶液,溶液会呈现KMnO4溶液的颜色,此时即达到了滴定终点,故答案为:滴入最后一滴KMnO4溶液时,溶液变为浅红色且半分钟内不褪色。
③n(KMnO4)= 0.01000mol/L×0.02000L=2×10-4mol,根据反应方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,n(Fe2+)=5×2×10-4mol=1×10-3mol,所以25.00mL 溶液中m(FeSO4·7H2O)= 1×10-3mol×278g/mol=0.2780g,则250mL溶液中的FeSO4·7H2O的质量为2.7800g,所以样品中FeSO4·7H2O的质量分数为:![]() =0.975。
=0.975。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)![]() 2C(g) ΔH<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合下图中曲线的是( )
2C(g) ΔH<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合下图中曲线的是( )
x | y |
| |
A | 温度 | 混合气体的平均相对分子质量 | |
B | 压强 | A的百分含量 | |
C | 再通入A | B的转化率 | |
D | 加入催化剂 | A的质量分数 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.常温下,将稀氨水逐滴加入稀硫酸中,当溶液的![]() 时,
时,![]()
B.两种醋酸溶液的物质的量浓度分别为![]() 和
和![]() ,pH分别为a和
,pH分别为a和![]() ,则
,则![]()
C.常温下,![]() 的NaOH溶液与
的NaOH溶液与![]() 的醋酸溶液等体积混合,滴入石蕊溶液呈红色
的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向![]() 的氨水中加入少量硫酸铵固体,则溶液中
的氨水中加入少量硫酸铵固体,则溶液中![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21。
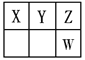
(1)写出W的简单离子的原子结构示意图为_____________;氢元素与Z形成原子个数比为1∶1的化合物,其结构式为__________;
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式表示)_______________;
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式为___________,反应中每转移8mol 电子,消耗的还原剂质量为_______g;
(4)写出能说明Y的非金属性比Z弱的一个实验事实:_____________;
Ⅱ.往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应:CO+ H2O(g)![]() CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为___________;
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为___________;
Ⅲ.甲醇燃料电池是一种相对理想的绿色能源,可用于电动汽车的电源;若该燃料电池以硫酸为电解质溶液,总反应为:2CH3OH + 3O2= 2CO2+ 4H2O,则其正极的电极反应式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保护环境,减少汽车尾气中污染物的排放量,汽车上需要安装三元催化器。
(1)三元催化器是利用催化剂将汽车尾气中的三种主要污染物转化为无害物质。这三种主要污染物是:![]() 、_____和________试写出在催化剂作用下,氨气还原
、_____和________试写出在催化剂作用下,氨气还原![]() 的化学方程式:_________,在该反应中氧化产物和还原产物的物质的量之比为______。
的化学方程式:_________,在该反应中氧化产物和还原产物的物质的量之比为______。
(2)北京市拟用甲醇替代液化石油气作为公交车的燃料,甲醇作为公交车燃料的好处是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,向50.00 mL未知浓度的CH3COOH溶液中逐滴加入0.5 mol·L-1的NaOH溶液。滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中正确的是
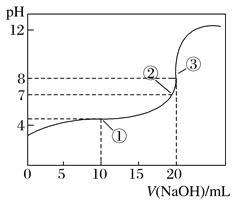
A.该中和滴定过程,最宜用石蕊作指示剂
B.图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度
C.图中点②所示溶液中,c(CH3COO-)=c(Na+)
D.滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,x mol·L-1氢氟酸水溶液中,加入KOH固体调节溶液的pH(忽略加入固体引起的溶液体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是 ( )。

A.当c(F-)>c(HF)时,溶液呈碱性
B.当pH=2时,c(F-)<c(K+)
C.25 ℃时,氢氟酸的电离平衡常数为4×10-6
D.当pH=5时,c(HF)+c(K+)+c(H+)-c(OH-)=x mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,
时,![]() 的
的![]() ,
,![]() ,室温下向10mL
,室温下向10mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象
溶液,如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象![]() 因有逸出未画出
因有逸出未画出![]() 。下列说法错误的是
。下列说法错误的是
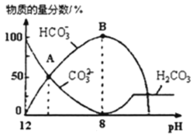
A.A点所示溶液的![]()
B.B点所示溶液:![]()
C.A点![]() 点发生反应的离子方程式为
点发生反应的离子方程式为![]()
D.分步加入酚酞和甲基橙,用滴定法可测定![]() 与
与![]() 混合物的组成
混合物的组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1L的恒容密闭容器中发生反应CO(g)+H2S(g)COS(g)+H2(g)△H=akJmol-1达到平衡。下列说法不正确的是
容器编号 | 温度/K | 物质的起始浓度/molL-1 | 物质的平衡浓度/molL-1 | |||
CO(g) | H2S(g) | COS(g) | H2(g) | COS(g) | ||
1 | T1 | 10.0 | 7.0 | 0 | 0 | 2.0 |
2 | T1 | 5.0 | 3.5 | 0 | 0 | |
3 | T2 | 3.0 | 0 | 7.0 | 7.0 | 1.5 |
A.若T1>T2,则a>0
B.T1K时,该反应的平衡常数K=0.1
C.容器3中反应达到平衡后,再充入1.1molH2S(g)和0.3molH2(g),平衡不移动
D.容器1中H2S的平衡转化率比容器2小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com