
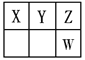
【题目】Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21。
(1)写出W的简单离子的原子结构示意图为_____________;氢元素与Z形成原子个数比为1∶1的化合物,其结构式为__________;
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式表示)_______________;
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式为___________,反应中每转移8mol 电子,消耗的还原剂质量为_______g;
(4)写出能说明Y的非金属性比Z弱的一个实验事实:_____________;
Ⅱ.往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应:CO+ H2O(g)![]() CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为___________;
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为___________;
Ⅲ.甲醇燃料电池是一种相对理想的绿色能源,可用于电动汽车的电源;若该燃料电池以硫酸为电解质溶液,总反应为:2CH3OH + 3O2= 2CO2+ 4H2O,则其正极的电极反应式______________。
【答案】 H-O-O-H NH4++H2O
H-O-O-H NH4++H2O![]() NH3·H2O + H+ C + 4HNO3
NH3·H2O + H+ C + 4HNO3![]() CO2↑ +4NO2↑ +2H2O 24 O2比N2更容易与氢气化合(或H2O比NH3更稳定,其它合理答案均可) 83.3% O2+ 4H++4e-=2H2O
CO2↑ +4NO2↑ +2H2O 24 O2比N2更容易与氢气化合(或H2O比NH3更稳定,其它合理答案均可) 83.3% O2+ 4H++4e-=2H2O
【解析】
Ⅰ.根据短周期元素X、Y、Z、W在元素周期表中的位置和X、Y、Z三种元素的质子数之和为21确定四种元素分别为C、N、O、S。
(1)H与O形成原子个数比为1∶1的化合物为H2O2;
(2)Y的最高价氧化物对应的水化物为硝酸,Y的氢化物为氨气,反应产物为硝酸铵,NH4+水解使溶液显酸性;
(3)浓硝酸与碳反应的方程式为C+4HNO3![]() CO2↑+4NO2↑+2H2O,根据化合价变化计算还原剂的质量;
CO2↑+4NO2↑+2H2O,根据化合价变化计算还原剂的质量;
(4)根据和氢气化合的难易程度、氢化物的稳定性以及最高价氧化物的水化物的酸性判断非金属性的强弱;
Ⅱ.根据化学平衡常数K=1,用三段式计算CO 的转化率;
Ⅲ.燃料电池的正极是氧气得到电子,根据电解质溶液为酸性写出正极的电极反应式。
Ⅰ.假设X的质子数为x,因为X、Y、Z三种元素的质子数之和为21,则x+(x+1)+(x+2)=21,解得x=6,则X为C元素、Y为N元素、Z为O元素、W为S元素。
(1)W为S,其离子结构示意图为 ;H元素与Z形成的原子个数比为1:1的化合物为H2O2,其结构式为H-O-O-H,故答案为
;H元素与Z形成的原子个数比为1:1的化合物为H2O2,其结构式为H-O-O-H,故答案为 ;H-O-O-H;
;H-O-O-H;
(2)Y的最高价氧化物对应的水化物为硝酸,Y的氢化物为氨气,反应产物为硝酸铵,其水溶液呈酸性,因为在水溶液中NH4+可以发生水解,离子方程式为NH4++H2O![]() NH3·H2O+H+,故答案为NH4++H2O
NH3·H2O+H+,故答案为NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(3)浓硝酸与碳反应的方程式为C+4HNO3![]() CO2↑+4NO2↑+2H2O,该反应中,C由0价上升至+4价态,N由+5价下降至+4价态,若有8mol电子发生转移,消耗还原剂C为2mol,质量为24g,故答案为C+4HNO3
CO2↑+4NO2↑+2H2O,该反应中,C由0价上升至+4价态,N由+5价下降至+4价态,若有8mol电子发生转移,消耗还原剂C为2mol,质量为24g,故答案为C+4HNO3![]() CO2↑+4NO2↑+2H2O;24;
CO2↑+4NO2↑+2H2O;24;
(4)比较非金属性的方法有很多,比如氧气比氮气更容易与氢气化合,或水比氨气更稳定等,故答案为O2比N2更容易与氢气化合或H2O比NH3更稳定等;
Ⅱ、设反应的CO的物质的量为x,

则平衡常数K=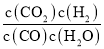
![]() =1,解得:x=
=1,解得:x=![]() mol,则CO的转化率=
mol,则CO的转化率=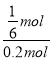 ×100%=83.3%,故答案为83.3%;
×100%=83.3%,故答案为83.3%;
Ⅲ.若该燃料电池以硫酸为电解质溶液,总反应为:2CH3OH + 3O2= 2CO2+ 4H2O,则正极上氧气得到电子发生还原反应,电极反应式为O2+ 4H++4e-=2H2O,故答案为O2+ 4H++4e-=2H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O,可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,已知H2O2足量,下列说法不正确的是( )
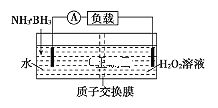
A.正极的电极反应式为3H2O2+6H++6e-═6H2O
B.H+通过质子交换膜向右侧移动
C.电池工作时,正、负极分别放出H2和NH3
D.当电路中转移0.6 NA电子,左右两极室质量差为1.9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一个容积为1L的密闭容器中,充入1molH2(g)和1mol I2(g),发生反应H2(g)+I2(g)![]() 2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g),则下列判断正确的是( )
I2(g),则下列判断正确的是( )
A.后一反应的平衡常数为1
B.后一反应的平衡常数为0.5
C.后一反应达到平衡时,H2的平衡浓度为0.25 mol·L-1
D.后一反应达到平衡时,HI(g)的平衡浓度0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]() B. Na+的结构示意图:
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根皮素J(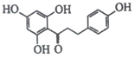 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
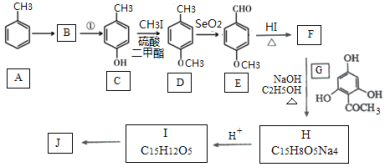
已知:
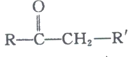 +R’’CHO
+R’’CHO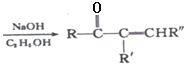 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中的官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应条件___________.
(3)写出由C生成D和由D生成E的反应类型___________、___________.
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL![]()
![]() 溶液中滴加
溶液中滴加![]() NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是
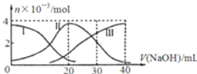
A.滴加过程中当溶液呈中性时,![]()
B.当![]() 时,则有:
时,则有:![]()
C.H![]() 在水中的电离方程式是:H
在水中的电离方程式是:H![]() ;
;![]()
D.当![]() 时,则有:
时,则有:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
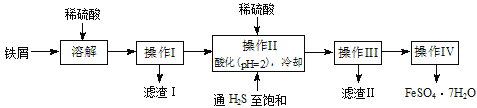
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是__________________________。
(2)操作II中,通入硫化氢至饱和的目的是_________________________________;在溶液中用硫酸酸化至pH=2的目的是___________________________________________。
(3)操作IV的顺序依次为:_________________、冷却结晶、__________________。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②________________________________________________________。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为:___________________。
②判断此滴定实验达到终点的方法是_______________________________________。
③计算上述样品中FeSO4·7H2O的质量分数为_________(用小数表示,保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图分析,下列说法正确的是( )
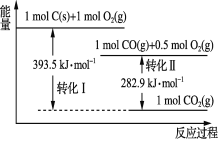
A.1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B.反应2CO(g)+O2(g)=2CO2(g)中,反应物的总键能小于生成物的总键能
C.C→CO的热化学方程式为2C(s)+O2(g)=2CO(g) ΔH=-110.6 kJ·mol-1
D.热值是指一定条件下单位质量的物质完全燃烧所放出的热量,则CO的热值为282.9 kJ·g-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.在醋酸溶液的![]() ,将此溶液稀释1倍后,溶液的
,将此溶液稀释1倍后,溶液的![]() ,则
,则![]()
B.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
C.![]() 盐酸的
盐酸的![]() ,
,![]() 盐酸的
盐酸的![]()
D.若1mL![]() 的盐酸与100mL
的盐酸与100mL![]() 溶液混合后,溶液的
溶液混合后,溶液的![]() 则
则![]() 溶液的
溶液的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com