
【题目】氨硼烷(NH3·BH3)电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O,可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,已知H2O2足量,下列说法不正确的是( )
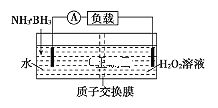
A.正极的电极反应式为3H2O2+6H++6e-═6H2O
B.H+通过质子交换膜向右侧移动
C.电池工作时,正、负极分别放出H2和NH3
D.当电路中转移0.6 NA电子,左右两极室质量差为1.9 g
【答案】C
【解析】
氨硼烷(NH3·BH3)电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O,分析化合价得到,过氧化氢化合价降低,在正极反应,NH3·BH3化合价升高,在负极反应。
A选项,过氧化氢化合价降低,在正极反应,其电极反应式为3H2O2+6H++6e-═ 6H2O,故A正确;
B选项,H+通过质子交换膜向右侧正极移动,故B正确;
C选项,电池工作时,正极生成水,负极生成NH4BO2,故C错误;
D选项,负极反应NH3·BH3+2H2O - 6e-=NH4BO2+6H+,根据A选项,当电路中转移0.6 NA电子时,左侧有0.6mol氢离子从左侧移动到右侧,左侧有0.1mol NH3·BH3参与反应,左侧质量增加0.1mol×31gmol-1-0.6mol×1gmol-1= 2.5g,右侧质量增加0.6mol×1gmol-1= 0.6g,因此左右两极室质量差为2.5g-0.6g = 1.9 g,故D正确。
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,硫化物的沉淀在溶液中达溶解平衡时,金属阳离子的浓度随S2-浓度的变化曲线如图所示。据图判断,下列说法错误的是 ( )
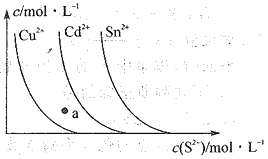
A.三种物质的溶度积大小为Ksp(CuS)<Ksp(CdS)<Ksp(SnS)
B.向SnS悬浊液中加入少量CuSO4固体,c(Sn2+)会减少
C.a点无CdS沉淀产生
D.向含等物质的量浓度的Cu2+、Sn2-的混合液中,滴加Na2S溶液,先析出CuS沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2+3H2![]() 2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
A.v(NH3)=0.1mol/(L·s)B.v(N2)=1.0mol/(L·min)
C.v(H2)=1.67mol/(L·min)D.v(H2)=0.3mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下,830℃时,向一个2 L的密闭容器中充入0.2 mol的A和0.8 mol的B。
C(g)+D(g)反应的平衡常数和温度的关系如下,830℃时,向一个2 L的密闭容器中充入0.2 mol的A和0.8 mol的B。
温度 | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)反应达平衡后,升高温度,平衡_______移动(填“正向”或“逆向”)
(2)830℃达平衡时,A的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参照反应Br+H2 ![]() HBr+H的反应历程示意图,下列叙述中正确的是
HBr+H的反应历程示意图,下列叙述中正确的是

A. 该反应的反应热△H=E2﹣E1
B. 正反应为吸热反应
C. 吸热反应一定要加热后才能发生
D. 升高温度可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)![]() 2C(g) ΔH<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合下图中曲线的是( )
2C(g) ΔH<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合下图中曲线的是( )
x | y |
| |
A | 温度 | 混合气体的平均相对分子质量 | |
B | 压强 | A的百分含量 | |
C | 再通入A | B的转化率 | |
D | 加入催化剂 | A的质量分数 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属与硝酸的反应,实验如下。
实验 (20C) | 现象 |
Ⅰ | 无色气体(遇空气变红棕色),溶液变为蓝色 |
Ⅱ | 6mL无色气体(经检测为H2),溶液几乎无色 |
⑴Ⅰ中产生的无色气体是______。
⑵研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是______。
![]() 乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
![]() 补全Ⅱ中NO3-被还原为
补全Ⅱ中NO3-被还原为![]() 的过程:NO3- + ______e- + ______= NH4+ + ______H2O
的过程:NO3- + ______e- + ______= NH4+ + ______H2O
⑶研究影响产生H2的因素
实验 | 现象 |
Ⅲ | 3.4m L气体(经检测为H2),溶液略带黄色 |
Ⅳ | 2.6m L气体(经检测为H2),黄色溶液 |
Ⅴ | 无色气体(遇空气变红棕色),深棕色溶液 |
资料:Fe[(NO)]2+在溶液中呈棕色。 ④对比Ⅱ、Ⅲ、Ⅳ,温度不同时收集到氢气的体积不同,原因是______。 ⑤Ⅴ中无色气体是混合气体,则一定含有遇空气变红棕色的气体和______。 ⑷根据实验,金属与硝酸反应时,影响硝酸的还原产物不同的因素有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21。
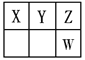
(1)写出W的简单离子的原子结构示意图为_____________;氢元素与Z形成原子个数比为1∶1的化合物,其结构式为__________;
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式表示)_______________;
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式为___________,反应中每转移8mol 电子,消耗的还原剂质量为_______g;
(4)写出能说明Y的非金属性比Z弱的一个实验事实:_____________;
Ⅱ.往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应:CO+ H2O(g)![]() CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为___________;
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为___________;
Ⅲ.甲醇燃料电池是一种相对理想的绿色能源,可用于电动汽车的电源;若该燃料电池以硫酸为电解质溶液,总反应为:2CH3OH + 3O2= 2CO2+ 4H2O,则其正极的电极反应式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com