
【题目】研究金属与硝酸的反应,实验如下。
实验 (20C) | 现象 |
Ⅰ | 无色气体(遇空气变红棕色),溶液变为蓝色 |
Ⅱ | 6mL无色气体(经检测为H2),溶液几乎无色 |
⑴Ⅰ中产生的无色气体是______。
⑵研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是______。
![]() 乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
![]() 补全Ⅱ中NO3-被还原为
补全Ⅱ中NO3-被还原为![]() 的过程:NO3- + ______e- + ______= NH4+ + ______H2O
的过程:NO3- + ______e- + ______= NH4+ + ______H2O
⑶研究影响产生H2的因素
实验 | 现象 |
Ⅲ | 3.4m L气体(经检测为H2),溶液略带黄色 |
Ⅳ | 2.6m L气体(经检测为H2),黄色溶液 |
Ⅴ | 无色气体(遇空气变红棕色),深棕色溶液 |
资料:Fe[(NO)]2+在溶液中呈棕色。 ④对比Ⅱ、Ⅲ、Ⅳ,温度不同时收集到氢气的体积不同,原因是______。 ⑤Ⅴ中无色气体是混合气体,则一定含有遇空气变红棕色的气体和______。 ⑷根据实验,金属与硝酸反应时,影响硝酸的还原产物不同的因素有______。
【答案】NO 硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出 NO3-中氮元素的化合价为最高价,具有氧化性 取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体 8 10H+ 3 相同条件下,温度升高时,化学反应速率增大,但NO3-的还原速率增大的更多 H2 金属的种类、硝酸的浓度、温度
【解析】
⑴Ⅰ中无色气体NO遇空气生成红棕色的二氧化氮气体。
⑵①依据Ⅰ和Ⅱ硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中生成NO,因此可得NO3-没有发生反应不正确。
②NO3-中氮元素的化合价为最高价,具有氧化性,证明NH4+的方法是去一定量溶液加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体。
③根据化合价降低得到电子配平得到。
⑶④根据现象和温度升高时,化学反应速率增大。
⑤根据元素分析和前面的信息得到答案。
⑷根据实验和几个反应现象得出答案。
⑴Ⅰ中产生的无色气体遇空气变为红棕色,则为NO遇空气生成红棕色的二氧化氮气体;
故答案为:NO。
⑵①依据Ⅰ和Ⅱ硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出,故认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应不正确,故答案为:硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出。
②元素的最高级具有氧化性,故NO3-中氮元素的化合价为最高价,具有氧化性,推测出NO3-也能被还原;证实该溶液中含有NH4+的方法为:取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体,故答案为:NO3-中氮元素的化合价为最高价,具有氧化性;取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体。
③NO3-被还原为NH4+的反应为:NO3- + 8e- + 10H+= NH4+ + 3H2O,故答案为:8;10H+;3。
⑶④根据现象可得,Ⅱ、Ⅲ生成氢气,Ⅳ生成有NO,因为相同条件下,温度升高时,化学反应速率增大,但NO3-的还原速率增大的更多,故答案为:相同条件下,温度升高时,化学反应速率增大,但NO3-的还原速率增大的更多。
⑤Ⅴ中无色气体是混合气体,根据元素分析,则一定含有遇空气变红棕色的NO气体和H2,故答案为:H2。
⑷根据实验,金属与硝酸反应时,影响硝酸的还原产物不同的因素有金属的种类、硝酸的浓度、温度,故答案为:金属的种类、硝酸的浓度、温度。


科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJ mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=﹣99 kJ mol-1。
请回答下列问题:
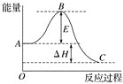
(1) 图中ΔH=___kJ mol-1。
(2) 如果反应速率υ(SO2)为0.05 molL-1min-1,则υ(O2)=___ molL-1min-1、υ(SO3)=____ molL-1min-1;
(3) 已知单质硫的燃烧热为296 kJ mol-1,计算由S(s)生成3 mol SO3(g)的ΔH=___kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O,可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,已知H2O2足量,下列说法不正确的是( )
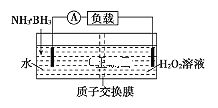
A.正极的电极反应式为3H2O2+6H++6e-═6H2O
B.H+通过质子交换膜向右侧移动
C.电池工作时,正、负极分别放出H2和NH3
D.当电路中转移0.6 NA电子,左右两极室质量差为1.9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,最终的白色沉淀不一定是BaSO4的是( )
A.Fe(NO3)2溶液![]()
![]()
![]() 白色沉淀
白色沉淀
B.Ba(NO3)2溶液![]()
![]() 白色沉淀
白色沉淀
C.无色溶液![]()
![]() 白色沉淀
白色沉淀
D.无色溶液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,其中P为电解质溶液。由此判断M、N、P所代表的物质可能是( )
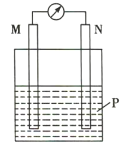
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 锌 | 稀硫酸 |
C | 银 | 锌 | AgNO3溶液 |
D | 铜 | 铁 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉花香气成分有多种,乙酸苯甲酯(![]() )是其中一种,它可以从茉莉花中提取,也可用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中一种,它可以从茉莉花中提取,也可用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
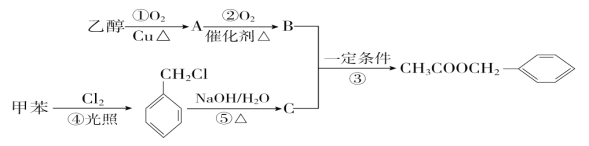
(1)B的结构简式分别为___;反应⑤的反应类型分别为___。
(2)写出反应①、③的化学方程式:
①____;
③____。
(3)反应___(填序号)原子的理论利用率为100%,符合“绿色化学”的要求。
(4)符合下列条件的乙酸苯乙酯的同分异构体的数目有___个
I、能发生银镜反应 II、能发生水解反且水解产物能与FeCl3溶液发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一个容积为1L的密闭容器中,充入1molH2(g)和1mol I2(g),发生反应H2(g)+I2(g)![]() 2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g),则下列判断正确的是( )
I2(g),则下列判断正确的是( )
A.后一反应的平衡常数为1
B.后一反应的平衡常数为0.5
C.后一反应达到平衡时,H2的平衡浓度为0.25 mol·L-1
D.后一反应达到平衡时,HI(g)的平衡浓度0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]() B. Na+的结构示意图:
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图分析,下列说法正确的是( )
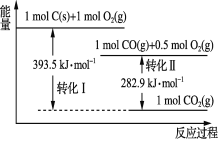
A.1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B.反应2CO(g)+O2(g)=2CO2(g)中,反应物的总键能小于生成物的总键能
C.C→CO的热化学方程式为2C(s)+O2(g)=2CO(g) ΔH=-110.6 kJ·mol-1
D.热值是指一定条件下单位质量的物质完全燃烧所放出的热量,则CO的热值为282.9 kJ·g-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com