
����Ŀ����1����̬ͭԭ�ӵĺ�������Ų�ʽΪ______________________ ����______��δ�ɶԵ���
��2����֪A��BΪ��������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��

�����й�A��B����������ȷ����___________
a. ���Ӱ뾶A<B b. �縺��A<B
c. ���ʵ��۵�A>B d. A��B�ĵ��ʾ�������������û���Ӧ
e. A��������������� f. A��B��������Ԫ�ع������Ӿ���
��3����ѧ��ͨ��X�����Ʋ���мȺ�����λ��,�ֺ������,��ṹʾ��ͼ�ɼ�ʾ���£�
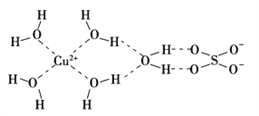
�ٵ����Ļ�ѧʽ����������ʽ��ʾΪ________________________
�ڵ�����SO42���Ŀռ乹��Ϊ_______________ ��H2O����ԭ�ӵ��ӻ�����Ϊ____________
��4��д��һ����CN����Ϊ�ȵ�����ķ��ӵĵ���ʽ______________��Na4[Fe(CN)6]�еĻ�ѧ������Ϊ_____________________
��5���þ����X�������䷨��ͭ�IJⶨ�õ����½����ͭ�ľ���Ϊ�����������ܶѻ�����֪�þ�����ܶ�Ϊ![]() g��cm��3,�����и�ԭ�ӵ���λ��Ϊ_____________��Cu��ԭ�Ӱ뾶Ϊ___________cm������٤������ΪNA��
g��cm��3,�����и�ԭ�ӵ���λ��Ϊ_____________��Cu��ԭ�Ӱ뾶Ϊ___________cm������٤������ΪNA��
���𰸡�1s22s22p63s23p63d104s1��[Ar] 3d104s1 1 bf [Cu(H20)4]SO4��H2O �������� sp3 ![]() ��
��![]() ���Ӽ�����λ�������Լ� 12
���Ӽ�����λ�������Լ� 12 ![]()
��������
������Ҫ�������ʽṹ��
��1����̬ͭԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar] 3d104s1 ����1��δ�ɶԵ���
��2��A��I4ͻ����A������B��I3ͻ����BΪþ��
�����й�A��B����������ȷ����bf��
a.���Ӳ�ṹ��ͬ���ӵİ뾶���ź˵�����������С���������Ӱ뾶A<B����a��ȷ��b. ͬ����Ԫ�ش����ҵ縺�������������Ե縺��A>B ����b����ȷ��c. A��ԭ�Ӱ뾶��С�����ɵ��ӽ϶࣬ʹ��A�Ľ�������ǿ�����Ե��ʵ��۵�A>B ����C��ȷ��d. 2Mg+CO2![]() 2MgO��C ��2Al+Fe2O3
2MgO��C ��2Al+Fe2O3![]() 2Fe+Al2O3������A��B�ĵ��ʾ�������������û���Ӧ ����d��ȷ��e. �������������ᷴӦ��������Ӧ ����e��ȷ��f. �Ȼ����ǹ��ۻ���������f����ȷ����ѡbf��
2Fe+Al2O3������A��B�ĵ��ʾ�������������û���Ӧ ����d��ȷ��e. �������������ᷴӦ��������Ӧ ����e��ȷ��f. �Ȼ����ǹ��ۻ���������f����ȷ����ѡbf��
��3���ٵ����Ļ�ѧʽ����������ʽ��ʾΪ[Cu(H20)4]SO4��H2O��
�ڵ�����SO42��������ԭ����ԭ�ӵļ۲���Ӷ�Ϊ4������SO42���Ŀռ乹��Ϊ����������H2O������ԭ����ԭ�ӵļ۲���Ӷ�Ϊ4��������ԭ�ӵ��ӻ�����Ϊsp3��
��4���ȵ������ԭ�������۵�������ȣ�һ����CN����Ϊ�ȵ�����ķ��ӵĵ���ʽ��![]() ��
��![]() ��Na4[Fe(CN)6]�еĻ�ѧ������Ϊ���Ӽ�����λ�������Լ���
��Na4[Fe(CN)6]�еĻ�ѧ������Ϊ���Ӽ�����λ�������Լ���
��5�������и�ԭ�ӵ���λ��Ϊ12������ƽ������4��ͭԭ�ӣ�4��ͭԭ�ӵ�����Ϊ4��64g/NA���������Ϊ256/(��NA) cm3�������߳�a��Cuԭ�Ӱ뾶r�Ĺ�ϵΪ![]() a=4r��a3=256/(��NA)����ˣ�Cu��ԭ�Ӱ뾶Ϊ
a=4r��a3=256/(��NA)����ˣ�Cu��ԭ�Ӱ뾶Ϊ![]() cm��
cm��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�о�ͭ��Ũ����ķ�Ӧ��ij��ѧ��ȤС���������ʵ�飮 ʵ��I����Ӧ����Ķ���̽��������ͼװ�ã��̶�װ������ȥ������ʵ��
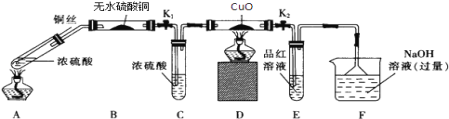
��1��Aװ�õ��Թ��з�����Ӧ�Ļ�ѧ����ʽ��________________________________��Fװ�õ�������______________________��Bװ���е�������_________________________��
��2��ʵ������У���֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص������ǣ�Dװ����____________��Eװ����_________________________��
��3��ʵ�����ʱ��Ӧ��_________���ٹر�K1 �� K2��Ȼ��ȥ���оƾ��ơ�
��4��ʵ�������֤��Aװ���Թ��з�Ӧ���ò����Ƿ���ͭ���ӣ��轫��Һϡ�ͣ�����������___________________________________________��
ʵ���Ӧ����Ķ���̽��
��5����ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣��Һ�ɫ����ΪCu2S������Cu2S�ķ�ӦΪa H2SO4+bCu ![]() cCu2S+dCuSO4+e H2O����a��b=_________________��
cCu2S+dCuSO4+e H2O����a��b=_________________��
��6��Ϊ�ⶨ����ͭ�IJ��ʣ����÷�Ӧ������Һ�кͺ����Ƴ�250.00mL��Һ��ȡ����Һ25.00mL��������KI��Һ�������ɵ�I2ǡ����20.00mL 0.30molL��1��Na2S2O3��Һ��Ӧ������Ӧ����ͭ������Ϊ9.6g��������ͭ�IJ���Ϊ_____________������֪2Cu2++4I��=2CuI+I2�� 2S2O32��+I2=S4O62��+2I������ע������ͭ�IJ���ָ��������ͭ��ʵ�ʲ��������۲����ı�ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������̼����ȼ�ϵ��ԭ��ʾ����ͼ�������йظõ�ص�˵����ȷ���ǣ� ��
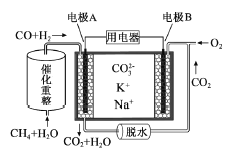
A. ��ӦCH4��H2O![]() 3H2��CO,ÿ����1molCH4ת��12mol ����
3H2��CO,ÿ����1molCH4ת��12mol ����
B. �缫A��H2����ĵ缫��ӦΪ��H2��2OH����2e��=2H2O
C. ��ع���ʱ��CO32����缫B�ƶ�
D. �缫B�Ϸ����ĵ缫��ӦΪ��O2��2CO2��4e��=2CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)��5O2(g)![]() 4NO(g)��6H2O(g)��������������ȷ����
4NO(g)��6H2O(g)��������������ȷ����
A. �ﵽ��ѧƽ��ʱ4v��(O2)��5v��(NO)
B. ����λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬
C. �ﵽ��ѧƽ��ʱ�������������������������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʵĹ�ϵ��2v��(NH3)��3v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij̽��С�����ñ�ͪ�������Ӧ(CH3COCH3��Br2![]() CH3COCH2Br��HBr)���о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ���� v(Br2) ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
CH3COCH2Br��HBr)���о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ���� v(Br2) ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
ʵ����� | ��ʼŨ��c/mol��L��1 | ����ɫ��ʧ����ʱ��t/s | ||
CH3COCH3 | HCl | Br2 | ||
�� | 0.80 | 0.20 | 0.0010 | 290 |
�� | 1.60 | 0.20 | 0.0010 | 145 |
�� | 0.80 | 0.40 | 0.0010 | 145 |
�� | 0.80 | 0.20 | 0.0020 | 580 |
����ʵ���������ó��Ľ�������ȷ����(����)
A������c(CH3COCH3)��v(Br2)����
B��ʵ��ں͢۵�v(Br2)���
C������c(HCl)��v(Br2)����
D������c(Br2)��v(Br2)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���Ա��ľ��������ȡ��������ø��POD�����ֱ������ֲ�ͬ�������ʼ�H2O2���д���Ӧ�������ͼ��ʾ���������˵����ȷ����
��������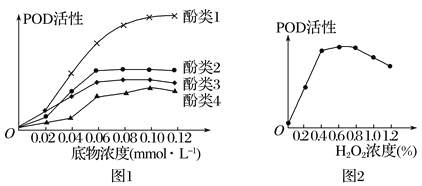
A. ͼ1��ʾ��ʵ��Ŀ����̽����ͬ�������ʵ�Ũ�ȶ�POD���Ե�Ӱ��
B. ������Ũ��Ϊ0.08 mmolL��1ʱ��POD������2�ķ�Ӧ����һ�����ڷ���3
C. ��ͼ2��֪��H2O2Ũ�ȹ�������POD�Ļ��ԣ�����Ũ�Ⱥ�POD�Ļ���һ����ָ�
D. H2O2��POD���Ե�Ӱ�����¶Ⱥ�pH��POD���Ե�Ӱ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y������Ԫ�أ�IΪ�����ܣ���λ��KJ/mol�������±����������жϴ�����ǣ� ��
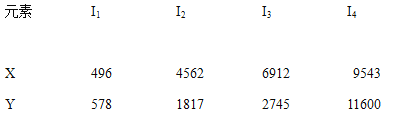
A. Ԫ��X�ij������ϼ���+1��
B. Ԫ��Y����A���Ԫ��
C. Ԫ��X�����γɻ�����ʱ����ѧʽ������XCl
D. ��Ԫ��Y���ڵ�3���ڣ���������ˮ���ҷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����Cl2ͨ��NaOH��Һ�У�������Һ�е�NaOH��ȫ�����ģ���Һ�д������ڵ�������ֻ��Cl-��ClO-��ClO3-������Һ�����������������������ӵ����ʵ���֮��Ϊ
A.1:3B.1��2C.1��1D.2:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ���ϩ��![]() ����˵��������ȷ���ǣ� ��
����˵��������ȷ���ǣ� ��
A. ����������ԭ�ӿ�����ͬһ��ƽ��
B. ��һ�������£�1mol ����ϩ�������4mol H2
C. ��H2��ַ�Ӧ��IJ���һ�ȴ�����5��
D. ����ϩ�ɷ�����ԭ��Ӧ��������Ӧ���ӳɷ�Ӧ���Ӿ۷�Ӧ��ȡ����Ӧ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com