
����Ŀ��Ϊ�о�ͭ��Ũ����ķ�Ӧ��ij��ѧ��ȤС���������ʵ�飮 ʵ��I����Ӧ����Ķ���̽��������ͼװ�ã��̶�װ������ȥ������ʵ��
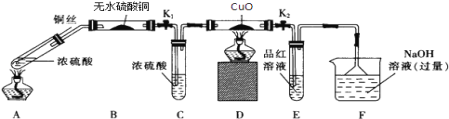
��1��Aװ�õ��Թ��з�����Ӧ�Ļ�ѧ����ʽ��________________________________��Fװ�õ�������______________________��Bװ���е�������_________________________��
��2��ʵ������У���֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص������ǣ�Dװ����____________��Eװ����_________________________��
��3��ʵ�����ʱ��Ӧ��_________���ٹر�K1 �� K2��Ȼ��ȥ���оƾ��ơ�
��4��ʵ�������֤��Aװ���Թ��з�Ӧ���ò����Ƿ���ͭ���ӣ��轫��Һϡ�ͣ�����������___________________________________________��
ʵ���Ӧ����Ķ���̽��
��5����ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣��Һ�ɫ����ΪCu2S������Cu2S�ķ�ӦΪa H2SO4+bCu ![]() cCu2S+dCuSO4+e H2O����a��b=_________________��
cCu2S+dCuSO4+e H2O����a��b=_________________��
��6��Ϊ�ⶨ����ͭ�IJ��ʣ����÷�Ӧ������Һ�кͺ����Ƴ�250.00mL��Һ��ȡ����Һ25.00mL��������KI��Һ�������ɵ�I2ǡ����20.00mL 0.30molL��1��Na2S2O3��Һ��Ӧ������Ӧ����ͭ������Ϊ9.6g��������ͭ�IJ���Ϊ_____________������֪2Cu2++4I��=2CuI+I2�� 2S2O32��+I2=S4O62��+2I������ע������ͭ�IJ���ָ��������ͭ��ʵ�ʲ��������۲����ı�ֵ��
���𰸡�Cu+2H2SO4��Ũ��= CuSO4+SO2��+2H2O ���ն����SO2����ֹ����Ⱦ���� ��ɫ��ĩ����ɫ ��ɫ������ɫ�ޱ仯 Ʒ����Һ��ɫ ����ͭ˿ ��Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬�۲��Ƿ�����ɫ���� 4��5 40%
��������
���������£�Cu��Ũ���ᷢ��������ԭ��Ӧ����CuSO4��SO2��H2O��SO2�������H2O��H2O��ʹ��ˮCuSO4����ɫ������Ũ������ˮ�ԣ�����SO2��H2���л�ԭ�ԣ��ܹ���ԭCuO��SO2����Ư���ԣ���ʹƷ����Һ��ɫ��SO2�ж��������ŷŵ���������Ҫ�ü�Һ���գ�
��1��ͭ��Ũ�����ڼ��������·�����Ӧ��Cu��2H2SO4(Ũ) ![]() CuSO4��SO2����2H2O��SO2����Ư���ԣ���ʹƷ����Һ��ɫ����������SO2��SO2�ж�������β����������NaOH��Һ�����������ն����SO2����ֹ����Ⱦ��������ˮ����ͭ�������Ǽ���������Ƿ���ˮ������ͭ��Ũ���ᷴӦ����ʽ�У������к���ˮ�����װ��B�������ǰ�ɫ��ĩ����ɫ��
CuSO4��SO2����2H2O��SO2����Ư���ԣ���ʹƷ����Һ��ɫ����������SO2��SO2�ж�������β����������NaOH��Һ�����������ն����SO2����ֹ����Ⱦ��������ˮ����ͭ�������Ǽ���������Ƿ���ˮ������ͭ��Ũ���ᷴӦ����ʽ�У������к���ˮ�����װ��B�������ǰ�ɫ��ĩ����ɫ��
��2��֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�أ�˵��Cu��Ũ���ᷴӦ����SO2��������H2����װ��D�й�����ɫ�ޱ仯��SO2����Ư���ԣ���ʹƷ����Һ��ɫ����װ��E��������Ʒ����Һ��ɫ��
��3��ʵ�����ʱ��Ӧ������ͭ˿���÷�Ӧֹͣ���ٹر�K1��K2����ֹC��E�е���Һ������ը�Ѳ����ܣ�
��4����֤���ɵ���Һ�к���Cu2������Ҫ���Թܵ�Һ�嵹��ˮ���ܽ⣬�۲��Ƿ������ɫ����Һ����Ϊ���з�Ӧ�����Һ�к������ᣬ��˲����ǽ�Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬�۲��Ƿ�����ɫ���֣�
��5�����ݷ�Ӧ����ʽ��CuԪ�ػ��ϼ���0�۱�Ϊ��1�ۡ���2�ۣ�SԪ�صĻ��ϼ��ɣ�6�۱�Ϊ��2�ۣ�ת�Ƶ�����Ϊ6�����ݵ�ʧ�������غ��Լ�ԭ���غ㣬�ó�5Cu��4H2SO4![]() Cu2S��3CuSO4��4H2O����a��b=4��5��
Cu2S��3CuSO4��4H2O����a��b=4��5��
��6�����ݷ�Ӧ����ʽ�ó���2Cu2����I2��2S2O32����250mL��Һ��n(Cu2��)=![]() =0.06mol����Ӧ����ͭ�����ʵ���Ϊ9.6g/64g��mol��1=0.15mol��������ͭ�IJ���Ϊ0.06mol/0.15mol��100%=40%��
=0.06mol����Ӧ����ͭ�����ʵ���Ϊ9.6g/64g��mol��1=0.15mol��������ͭ�IJ���Ϊ0.06mol/0.15mol��100%=40%��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ƶ���������ԀΪ�������һ���������������š������øֻ������������������ܹ㷺Ӧ�����ճ������������������ʱ���溬�м�����������ʹ�øֻ������ڼ��������µ�ʹ���ܵ�����.
��1����̬��ԭ�Ӽ۲���ӵĹ������ʽ(�����Ų�ͼ)Ϊ____________����̬��ԭ���к������ռ������ܲ�ķ���Ϊ_____________.
��2��Ni(CO)4�������Ʊ������������Ҵ���CCl4�������л��ܼ���Ϊ___________���壬Ni(CO)4�ռ乹���������ͬ������ԭ�ӵ��ӻ��������Ϊ___________��д�������廥Ϊ�ȵ������������__________________________________________________________(��дһ��).
��3������ͬ�����Ԫ�������ֳ����Ķ�Ԫ�����ᣬ��Ƚ���������ǿ�� > (�ѧʽ)______��������_______________________________________________________________.
��4��H2S�ļ���__________(����ڡ���С�ڡ������ڡ�)H2O�ļ��ǣ���ӵ縺�ԵĽǶ�˵������___________________________________________________.
��5��NiO��NaCl�ľ����ṹ���ƣ���ͼ��ʾ�������Ӳ�ȡ���������ѻ��������������λ�������ӹ��ɵĿ�϶�У���֪Ni2+�뾶Ϊ69nm��O2-�뾶Ϊ140nm������٤������ΪNA��NiO������ܶ�Ϊ_________g/cm3(ֻ�г�����ʽ).

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������������ɳ�����չ������أ�����˵������ȷ����
A.���ع��ͻ��ռӹ���ȼ�ϣ��������Դ��������
B.����Ǧ���ء���п�̵Ⱥ��ؽ���Ԫ�صĸɵ�ص�������������������
C.�ƹ�ʹ�þ�̼�����ȿɽ������ϣ��ɼ��ٰ�ɫ��Ⱦ
D.��ʯȼ�ϵ��̲��������Ҳ������������ս���ݽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£���10mLŨ�Ⱦ�Ϊ0.1mol��L-1��NaOH��Na2CO3�����Һ�е�0.1mol��L-1�����ᣬ��ҺpH�������������ı仯��ͼ��ʾ������˵����ȷ����
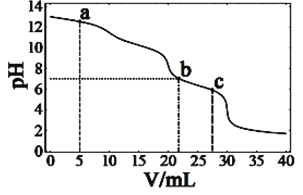
A. ��a�����Һ�У�c(Na+)��c(CO32-)��c(Cl-)��c(OH-)��c(H+)
B. ��b�����Һ�У�2n(CO32-)��n(HCO3-)��0.001mol
C. ��c�����ҺpH��7������Ϊ��ʱHCO3-�ĵ�������������ˮ������
D. ����0.1mol��L-1�����ỻ��ͬŨ�ȵĴ��ᣬ��������Һ��pH��7ʱ��c(Na+)��c(CH3COO-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���֤��ij������������ʵ���(����)
A.����ʱ������
B.ˮ��Һ�ĵ��������ܲ�
C.�������ӻ�������Ǽ��Թ��ۻ�����
D.��Һ���ѵ�������Ӻ�δ����ķ��ӹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ�������
A.����������������Ӱٷ�������ѧ��Ӧ����һ������
B.�������ҷ��ȵķ�Ӧһ�����Է���Ӧ
C.�κ������£���ѧ��Ӧ���ʱ䶼���ڻ�ѧ��Ӧ�ķ�Ӧ��
D.������������ܹ�����ˮ����Ϊ������ˮ��һ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ʢ��ϡ������ձ��з����õ������ӵĵ缫X��Y,���·�е���������ͼ��ʾ�����й��ڸ�װ�õ�˵����ȷ����

A. ���·�ĵ�������ΪX![]() ���·
���·![]() Y
Y
B. �����缫�ֱ�ΪFe��̼������X Ϊ̼����Y ΪFe
C. X ���Ϸ������ǻ�ԭ��Ӧ��Y ���Ϸ�������������Ӧ
D. �����缫���ǽ����������ǵĻ�����˳��ΪX>Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ���������O2��NO��NO2��N2��CO2�е�һ�ֻ�����ɣ��û�������ŵ���ɺ���ɫ��ԭ������ijɷ���һ�����У� ��
A.N2��O2��NOB.N2��O2��CO2
C.N2��NOD.N2��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����̬ͭԭ�ӵĺ�������Ų�ʽΪ______________________ ����______��δ�ɶԵ���
��2����֪A��BΪ��������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��

�����й�A��B����������ȷ����___________
a. ���Ӱ뾶A<B b. �縺��A<B
c. ���ʵ��۵�A>B d. A��B�ĵ��ʾ�������������û���Ӧ
e. A��������������� f. A��B��������Ԫ�ع������Ӿ���
��3����ѧ��ͨ��X�����Ʋ���мȺ�����λ��,�ֺ������,��ṹʾ��ͼ�ɼ�ʾ���£�
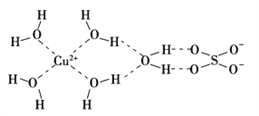
�ٵ����Ļ�ѧʽ����������ʽ��ʾΪ________________________
�ڵ�����SO42���Ŀռ乹��Ϊ_______________ ��H2O����ԭ�ӵ��ӻ�����Ϊ____________
��4��д��һ����CN����Ϊ�ȵ�����ķ��ӵĵ���ʽ______________��Na4[Fe(CN)6]�еĻ�ѧ������Ϊ_____________________
��5���þ����X�������䷨��ͭ�IJⶨ�õ����½����ͭ�ľ���Ϊ�����������ܶѻ�����֪�þ�����ܶ�Ϊ![]() g��cm��3,�����и�ԭ�ӵ���λ��Ϊ_____________��Cu��ԭ�Ӱ뾶Ϊ___________cm������٤������ΪNA��
g��cm��3,�����и�ԭ�ӵ���λ��Ϊ_____________��Cu��ԭ�Ӱ뾶Ϊ___________cm������٤������ΪNA��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com